 |
|
Cơ chế bệnh sinh của xơ hóa gan từ mức độ tế bào đến phân tử - Điều trị xơ gan bằng thuốc
I. Mở đầu
Nhiều tiến bộ đáng kể trong nghiên cứu về xơ hóa gan đã dẫn đến một sự hiểu biết mới về cách gan tạo thành sẹo đáp ứng với tổn thương và chỉ ra cách tiếp cận mới để điều trị xơ hóa gan. Những tiến bộ này bao gồm cô lập và đặc trưng hóa các loại tế bào gây xơ hóa ở gan, làm sáng tỏ cơ chế gây bệnh và làm rõ các chất trung gian. Bài này sẽ xem xét sự tiến bộ đáng kể trong việc hiểu biết về sinh lý bệnh của xơ hóa gan và làm thế nào điều này đã dẫn đến một phương thức mới hợp lý để điều trị chống xơ hóa.
Xơ hóa gan liên quan đến sự tích tụ chất cơ bản ngoại bào ở mô kẽ hoặc 'sẹo' sau tổn thương gan cấp tính hoặc mạn tính. Xơ gan, giai đoạn cuối của sự xơ hóa tiến triển, được đặc trưng bởi sự hình thành vách ngăn và nốt sẹo xung quanh tế bào gan. Thành phần phân tử của chất cơ bản ngoại bào ở gan xơ hóa tương tự như của nhu mô xơ hóa khác bao gồm phổi và thận và cũng tương tự trong các bệnh nguyên khác nhau của bệnh gan. Thông thường, sự xơ hóa cần có nhiều năm hoặc nhiều thập kỷ mới trở nên rõ ràng trên lâm sàng, nhưng trường hợp ngoại lệ đáng chú ý trong đó xơ gan phát sinh sau nhiều tháng có thể bao gồm bệnh gan ở trẻ em (ví dụ hẹp đường mật), bệnh gan do thuốc và viêm gan do virus liên quan tới sự ức chế miễn dịch sau ghép gan.
II. Nguồn tế bào của chất cơ bản ngoại bào ở gan bình thường và gan xơ hóa
Tế bào hình sao ở gan (trước đây gọi là tế bào mỡ, tế bào to, tế bào dự trữ mỡ hoặc tế bào quanh mao mạch hình sin) là nguồn chủ yếu ở gan bình thường và gan xơ hóa. Ngoài ra, các loại tế bào trung mô liên quan từ nhiều nguồn khác nhau cũng có thể góp phần nhỏ vào tổng tích lũy chất cơ bản, bao gồm nguyên bào sợi ở khoảng cửa cổ điển (đặc biệt là xơ hóa đường mật), tế bào có nguồn gốc từ tủy xương cũng như sự chuyển dạng biểu mô-trung mô (EMT) có nguồn gốc từ nguyên bào sợi . Chuyển dạng biểu mô-trung mô là một đáp ứng của thận được đặc trưng rõ đối với tổn thương, nhưng vai trò của nó trong tổn thương gan ít thuyết phục.
Tế bào hình sao ở gan là những tế bào quanh mao mạch hình sin trong khoang dưới nội mô giữa tế bào gan và các tế bào nội mô mao mạch hình sin. Như là vị trí dự trữ chính đối với retinoid (hợp chất vitamin A), các tế bào hình sao có thể được nhận biết bởi vitamin A tự phát huỳnh quang của chúng, định hướng quanh mao mạch tế bào hình sao và bởi biểu hiện của desmin là protein của bộ khung tế bào và protein sợi có tính acid của tế bào thần kinh đệm.
Khái niệm ‘tế bào hình sao' có thể thực sự đại diện cho một quần thể tế bào trung mô không đồng nhất về phenotype của bộ khung tế bào, hàm lượng vitamin A và sự khu trú. Hơn nữa, tính linh động đáng kể về phenotype của tế bào hình sao đã được ghi nhận in vivo và trong nuôi cấy làm loại trừ định nghĩa nghiêm ngặt chỉ dựa trên phenotype của bộ khung tế bào . Ngoài ra, các tế bào hình sao với khả năng gây xơ hóa không chỉ giới hạn đối với gan và đã được xác định ở tụy, ví dụ, ở đó chúng góp phần vào sự tạo mô xơ trong viêm tụy mạn tính và ung thư biểu mô . Một nguồn gốc chung của các tế bào hình sao ở gan và tụy được đề nghị mạnh mẽ bởi sự tương tự rõ rệt về hồ sơ phiên mã của chúng .
III. Hoạt hóa tế bào hình sao, một sự kiện trung tâm trong xơ hóa gan
‘Hoạt hóa’ tế bào hình sao đề cập đến sự thay đổi tế bào và phân tử một cách liên tục trong đó các tế bào hình sao trải qua một quá trình chuyển đổi từ một tế bào giàu vitamin A không hoạt động thành một tế bào gây xơ hóa ở mức độ cao, được đặc trưng bởi sự mở rộng của lưới nội bào tương thô, giảm các giọt vitamin A, màng nhân bị xáo trộn, xuất hiện các sợi co bóp và tăng sinh. Các tế bào với các đặc điểm không hoạt động và được hoạt hóa thường được gọi là ‘tế bào chuyển tiếp’. Tế bào hình sao hiện nay được đặc trưng trong nhiều bệnh gan ở người. Bệnh gan do rượu là ví dụ tốt nhất được nghiên cứu, với nhiều báo cáo ghi nhận các đặc điểm hoạt hóa tại chỗ ; sự hoạt hóa thậm chí có thể xảy ra khi có nhiễm mỡ đơn độc mà không có viêm . Tế bào hình sao được hoạt hóa cũng đã được xác định trong viêm gan do virus và ung thư biểu mô tế bào gan, chúng góp phần vào sự lắng đọng chất đệm liên quan đến khối u . Tế bào hình sao được đặc trưng thêm trong một số bệnh khác ở người, bao gồm bệnh tim mạch, bệnh ác tính về máu, bệnh đường mật, bệnh mucopolysaccharide, quá liều paracetamol, bệnh Leishmania, thải mảnh ghép cùng loài và ở người lạm dụng ma túy.
Sự sản sinh chất cơ bản ngoại bào bởi các tế bào nội mô mao mạch hình sin, trong khi ít hơn so với tế bào hình sao, tuy nhiên vẫn là một thành phần quan trọng của sự xơ hóa giai đoạn sớm. Cũng giống như các tế bào hình sao, có sự không đồng nhất đáng kể của các tế bào nội mô mao mạch hình sin trong gan bình thường và gan xơ hóa. Tế bào nội mô của gan bình thường sản sinh collagen loại 3 và 4, laminin, syndecan và fibronectin . Sau tổn thương gan cấp tính, sự tăng biểu hiện các đồng dạng tế bào của fibronectin bởi những tế bào này là một sự kiện chủ yếu lúc ban đầu , vì sự xuất hiện của chúng tạo ra một vi môi trường hoạt hóa tế bào hình sao.
1.Các con đường hoạt hóa tế bào hình sao (Hình 1)
Sự hoạt hóa tế bào hình sao được quan niệm trong 2 giai đoạn chính của sự tiến triển: khởi đầu (còn gọi là giai đoạn tiền viêm) và vĩnh viễn , cũng như một giai đoạn thoái lui chính . Giai đoạn khởi đầu đề cập đến những thay đổi sớm về biểu hiện gen và phenotype làm cho tế bào đáp ứng với các cytokine và kích thích khác, trong khi kết quả vĩnh viễn do tác động của các kích thích này trong việc duy trì phenotype hoạt hóa và tạo ra sự xơ hóa. Giai đoạn khởi đầu phần lớn là do sự kích thích paracrine (cận tiết), trong khi giai đoạn vĩnh viễn liên quan đến vòng autocrine (tự tiết) cũng như paracrine (cận tiết).
2.Giai đoạn khởi đầu của sự hoạt hóa tế bào hình sao
Những thay đổi sớm nhất ở các tế bào hình sao có thể là do kích thích paracrine (cận tiết) bởi tất cả các loại tế bào lân cận, bao gồm cả tế bào nội mô mao mạch hình sin, tế bào Kupffer, tế bào gan và tiểu cầu. Như đã lưu ý trên, tổn thương sớm tế bào nội mô kích thích sản sinh fibronectin của tế bào, có tác dụng hoạt hóa tế bào hình sao . Các tế bào nội mô cũng có thể tham gia vào sự chuyển đổi yếu tố tăng trưởng chuyển dạng (TGF)-β từ dạng tiềm ẩn đến dạng tiền gây xơ hóa hoạt động. Các tế bào nội mô mao mạch hình sin, thường có lỗ nhỏ (cửa sổ) để cho phép vận chuyển các chất tan 2 chiều nhanh chóng giữa tế bào nhu mô và tế bào máu hình sin, có thể nhanh chóng mất các lỗ nhỏ của chúng khi tổn thương và biểu hiện các phân tử tiền viêm bao gồm phân tử kết dính gian bào (ICAM)-1, yếu tố tăng trưởng nội mô mạch máu (VEGF) và phân tử kết dính . Cùng với các tế bào hình sao, chúng hoạt hóa con đường tạo mạch để đáp ứng với tình trạng thiếu oxy liên quan với tổn thương hoặc bệnh ác tính tại chỗ .
Sự kích thích sớm tế bào hình sao bởi peroxide lipid góp phần vào nhiều dạng xơ hóa của gan, đặc biệt là viêm gan C, viêm gan nhiễm mỡ không do rượu (NASH) và thừa sắt . Trong thực tế, có sự tăng tỷ lệ dị hợp tử về đột biến gen của bệnh nhiễm sắc tố sắt mô ở bệnh nhân bị viêm gan nhiễm mỡ không do rượu, cho thấy khả năng có mối quan hệ hiệp đồng giữa thừa chất béo và thừa sắt . Ngoài ra, có nhiều khả năng xơ hóa ở những bệnh nhân béo phì bị viêm gan nhiễm mỡ không do rượu, tương quan với sự tăng nhiễm mỡ gan . Nhóm các chỉ điểm sinh hóa đã được tạo ra để nâng cao dự đoán xơ hóa ở bệnh nhân viêm gan nhiễm mỡ không do rượu . Do nồng độ các chất chống oxy hóa thường bị cạn kiệt trong gan xơ, khi xơ hóa tiến triển, sự mất này có thể làm tăng thêm tác dụng có hại của peroxide lipid.
Tế bào sao, loại tế bào có nhiều nhất ở gan, là một nguồn mạnh của các peroxide lipid gây xơ hóa này. Có một sự tương quan tại chỗ giữa sự hiện diện của aldehyde adduct và biểu hiện gen collagen bởi tế bào hình sao và peroxide kích thích tổng hợp collagen của tế bào hình sao được nuôi cấy . Nhiễm mỡ trong viêm gan nhiễm mỡ không do rượu và nhiễm virus viêm gan C (HCV) tương quan với sự tăng hoạt hóa tế bào hình sao và gây xơ hóa , có thể vì chất béo đại diện cho một nguồn tăng cường của peroxide lipid. Trong nuôi cấy, sự hoạt hóa các tế bào hình sao được gây ra bởi sự hình thành các gốc tự do và bị chặn lại bởi các chất chống oxy hóa .
Trong khi sự hoại tử tế bào gan liên quan với peroxide hóa lipid được xem là một dạng viêm cổ điển và kích thích gây xơ hóa, các kết quả nghiên cứu gần đây cũng bao hàm apoptosis - sự chết tế bào theo chương trình, trong đáp ứng gây xơ hóa . Các mảnh tế bào chết theo chương trình được phóng thích từ tế bào gan là các tế bào hình sao được nuôi cấy có xu hướng gây xơ hóa, một phần thông qua sự cảm ứng nicotinamide adenine dinucleotide phosphate hydrogenase (NADPH) oxidase và cũng hoạt hóa tế bào Kupffer . Ngoài ra, sự chết tế bào gan theo chương trình qua trung gian Fas in vivo ở động vật thí nghiệm gây xơ hóa .
Tiểu cầu là một nguồn mạnh của các yếu tố tăng trưởng trong tổn thương gan , tuy nhiên khả năng góp phần của chúng phần lớn đã bị bỏ qua. Các chất trung gian tiểu cầu quan trọng bao gồm yếu tố tăng trưởng có nguồn gốc tiểu cầu (PDGF), TGF-β1 và yếu tố tăng trưởng biểu bì (EGF).
Hình 1 Đặc điểm phenotype của sự hoạt hóa tế bào hình sao của gan trong tổn thương gan và sự thoái lui. Sau tổn thương gan, các tế bào hình sao của gan trải qua 'sự hoạt hóa', trong đó chúng được chuyển dạng từ tế bào giàu vitamin A không hoạt động thành nguyên bào sợi cơ tăng sinh, gây xơ hóa và co bóp. Những thay đổi phenotype chính sau sự hoạt hóa bao gồm tăng sinh, co bóp, gây xơ hóa, thoái hóa chất cơ bản, hóa ứng động, mất retinoid và sức hút hóa học đối với bạch cầu (WBC). Các chất trung gian chính của những tác dụng này được biểu thị. Số phận của các tế bào hình sao được hoạt hóa trong sự thoái lui tổn thương gan không chắc chắn nhưng có thể bao gồm sự đảo ngược trở lại phenotype không hoạt động hoặc sự làm sạch chọn lọc bởi sự chết tế bào theo chương trình. ECM: chất cơ bản ngoại bào (extracellular matrix); cFn: Fibronectin tế bào (cellular fibronectin); PDGF: yếu tố tăng trưởng có nguồn gốc tiểu cầu (platelet-derived growth factor); ET-1: endothelin-1; TGF-β1: yếu tố tăng trưởng chuyển dạng β1; MMP-2: matrix metalloproteinase-2; MCP-1: monocyte chemoattractant protein-1; HSC: tế bào hình sao của gan .
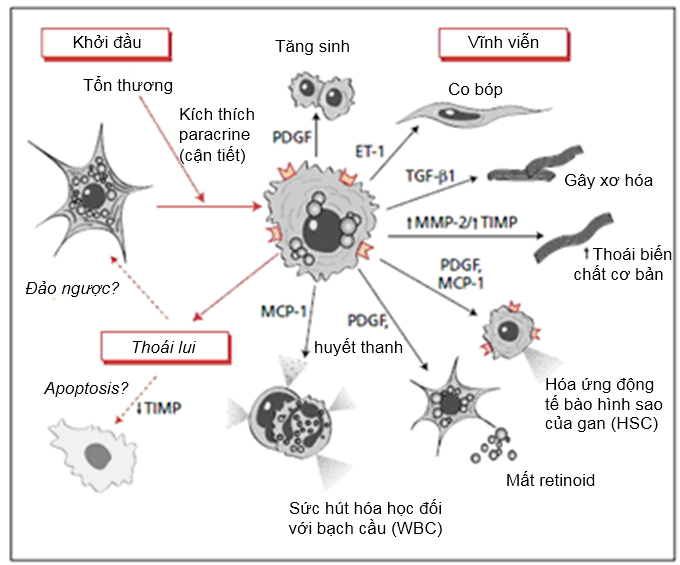
3.Tính vĩnh viễn của sự hoạt hóa tế bào hình sao
Tính vĩnh viễn của sự hoạt hóa tế bào hình sao phản ánh sự thay đổi khác biệt trong cách hoạt động của tế bào bao gồm: (i) tăng sinh; (ii) hóa ứng động; (iii) gây xơ hóa; (iv) co bóp; (v) thoái biến chất cơ bản; (vi) mất retinoid; (vii) sức hút hóa học đối với bạch cầu (WBC) và phóng thích cytokine. Hoặc trực tiếp hoặc gián tiếp, tác dụng thực của những thay đổi này là nhằm tăng sự tích tụ chất cơ bản ngoại bào. Ví dụ, tăng sinh và hóa ứng động dẫn đến tăng số lượng tế bào sản sinh collagen, nhưng còn có sự sản sinh chất cơ bản thêm ở mỗi tế bào. Sự phóng thích cytokine của các tế bào hình sao có thể làm tăng phản ứng viêm và đáp ứng mô gây xơ hóa, và protease chất cơ bản có thể đẩy nhanh sự thay thế chất cơ bản bình thường bằng một 'sẹo' vết thương điển hình.
a.Tăng sinh
PDGF là mitogen tế bào hình sao mạnh nhất đã được xác định . Sự cảm ứng thụ thể PDGF sớm trong hoạt hóa tế bào hình sao làm tăng đáp ứng với mitogen mạnh này . Các đường dẫn truyền xuôi dòng của tín hiệu PDGF đã được đặc trưng rõ trong tế bào hình sao . PDGF cũng kích thích sự trao đổi Na+ / H+, cung cấp một điểm tiềm năng để can thiệp điều trị bằng cách ngăn chặn sự vận chuyển ion . Biểu hiện biến đổi gen của PDGF-C ở chuột nhắt dẫn đến cả xơ hóa gan và ung thư biểu mô tế bào gan , nâng cao vai trò tiềm năng của các cytokine trong sự sinh ung thư cũng như xơ hóa. Các hợp chất khác với hoạt tính mitogen và/hoặc gây xơ hóa trong các tế bào hình sao bao gồm VEGF , thrombin và thụ thể của nó , EGF, TGF-β, yếu tố tăng trưởng tế bào sừng và yếu tố tăng trưởng nguyên bào sợi cơ bản (βFGF) . Con đường truyền tín hiệu đối với những chất này và các mitogen khác đã được làm rõ rất nhiều về các tế bào hình sao.
b.Hóa ứng động
Các tế bào hình sao có thể di chuyển theo hướng sức hút hóa học đối với cytokine qua trung gian của một số thụ thể của màng cũng là đặc trưng của tế bào trung mô thâm nhiễm vết thương ở các mô khác. Hóa ứng động các tế bào hình sao giải thích một phần lý do tại sao các tế bào hình sao sắp xếp trong vách ngăn trong viêm in vivo.
c.Gây xơ hóa
Sự tăng sản sinh chất cơ bản bởi tế bào gây xơ hóa góp phần đáng kể vào sự tích tụ chất cơ bản trong xơ hóa gan. Sự điều hòa gen collagen I trong các tế bào hình sao cung cấp một mô hình quan trọng cho hiểu biết về sinh lý bệnh đối với sự gây xơ hóa của tế bào hình sao . Sự kích thích mạnh nhất đối với việc sản sinh collagen I là TGF-β1, có nguồn gốc từ cả nguồn paracrine và autocrine; TGF-β1 cũng kích thích sản sinh các thành phần chất cơ bản khác, bao gồm cả fibronectin và proteoglycan của tế bào . TGF-β1 kích thích collagen trong các tế bào hình sao thông qua cơ chế phụ thuộc hydrogen peroxide-, p38 MAPK- và C/EBPβ . Biểu hiện của TGF-β tăng ở bệnh nhân viêm gan C mạn tính, nhấn mạnh tầm quan trọng tiềm năng của cytokine này trong bệnh gan mạn tính . Tương tự như vậy, nồng độ TGF-β trong huyết thanh tương quan với nguy cơ mắc bệnh tắc tĩnh mạch sau ghép tủy xương . Ngoài ra, đáp ứng của tế bào hình sao với TGF-β1 tăng lên trong quá trình hoạt hóa do tăng gắn kết ligand với các thụ thể cùng nguồn gốc của nó .
Tín hiệu xuôi dòng của TGF-β1 bao gồm một họ các phân tử hai chức năng được gọi là Smads, nhờ đó nhiều tín hiệu ngoại bào và nội bào hội tụ để tinh chỉnh và tăng cường thêm các tác dụng của TGF-β trong sự gây xơ hóa, xuôi dòng của các thụ thể của nó . Phản ứng của Smads ở các tế bào hình sao khác nhau giữa tổn thương cấp tính và mạn tính với sự sản sinh thêm chất cơ bản có lợi . Smads 2 và 3 tạo ra các phản ứng tín hiệu riêng biệt thúc đẩy hoạt hóa tế bào hình sao và gây xơ hóa , trong khi Smad 7 thì ức chế, làm cho nó trở thành một phân tử hấp dẫn để sử dụng trong liệu pháp chống xơ hóa.
Sự hiểu biết tiếp tục về phiên mã, dịch mã gen collagen và sự ổn định mRNA đã nhấn mạnh nhiều vị trí điều hòa có thể ảnh hưởng đến sự sản sinh collagen . Sản phẩm peroxide lipid được công nhận là sự kích thích quan trọng đối với việc sản sinh chất cơ bản ngoại bào, đặc biệt là khi có nguồn gốc từ tế bào gan . Tác dụng của chúng có thể tăng lên do sự mất khả năng chống oxy hóa của các tế bào hình sao khi chúng được hoạt hóa . Những hiểu biết quan trọng này đã kích thích các nỗ lực để sử dụng chất chống oxy hóa như điều trị đối với sự xơ hóa gan (xem phần can thiệp bằng thuốc trong xơ hóa gan). Sự kích thích của việc gây xơ hóa có thể đặc biệt quan trọng trong sinh bệnh học của viêm gan nhiễm mỡ không do rượu (NASH), trong đó mỡ cung cấp một kho chứa lớn về các loại oxy phản ứng tiềm năng . Ngoài TGF-β1, yếu tố tăng trưởng mô liên kết (hiện nay gọi là CCN2) cũng là một cytokine gây xơ hóa được điều hòa bởi TGF-β .
d.Sự co bóp
Sự co bóp của các tế bào hình sao có thể là một yếu tố quyết định chính của sự gia tăng sớm và muộn về sức cản tĩnh mạch cửa trong xơ hóa gan. Các tế bào hình sao được hoạt hóa gây cản trở lưu lượng máu tĩnh mạch cửa bởi sự co thắt của của các mao mạch hình sin riêng lẻ và sự co của gan xơ, vì các dải collagen điển hình của xơ gan giai đoạn cuối chứa một số lượng lớn các tế bào hình sao được hoạt hóa .
Khi các tế bào hình sao trở nên co bóp, sự biểu hiện của α-smooth muscle actin là protein bộ khung tế bào tăng lên. Sự phát hiện α-actin dường như là một yếu tố dự đoán quan trọng trên lâm sàng về sự xơ hóa tiếp theo, đặc biệt là trong viêm gan nhiễm mỡ không do rượu hoặc sau ghép gan.
Kích thích co bóp chính đối với các tế bào hình sao là endothelin-1, có các thụ thể được biểu hiện trên cả tế bào hình sao không hoạt động và được hoạt hóa, nhưng thành phần tiểu đơn vị của chúng có thể thay đổi . Không giống như các thụ thể PDGF, biểu hiện thụ thể endothelin không làm tăng hoạt hóa tế bào hình sao nhưng có một sự thay đổi về loại thụ thể endothelin chiếm ưu thế, kết hợp với sự tăng nhạy cảm với autocrine endothelin-1 . Nồng độ endothelin tăng do tăng hoạt tính của enzyme chuyển endothelin (ECE) do sự làm ổn định ECE mRNA . Sự co bóp của các tế bào hình sao đáp ứng với endothelin-1 cũng đã được ghi nhận in vivo cũng như trong nuôi cấy tế bào.
Chất trung gian gây co bóp quan trọng khác ở các tế bào hình sao được hoạt hóa là angiotensin II, được tổng hợp bởi các tế bào hình sao được hoạt hóa theo con đường phụ thuộc NADPH . Những phát hiện này đặc biệt có có ý nghĩa đối với bệnh ở người, vì sự đối kháng của con đường này là một liệu pháp chống xơ hóa hấp dẫn, sử dụng nhiều loại thuốc an toàn, được dung nạp tốt hiện có (xem dưới đây) . Sự co bóp cũng có thể được gây ra trong các tế bào hình sao được hoạt hóa bởi vasopressin , chất P và peptide natri niệu tâm nhĩ (atrial natriuretic peptide - ANP) .
Chất giãn mạch được sản sinh tại chỗ có thể chống lại tác dụng co thắt của endothelin-1 . Nitric oxide, cũng được sản sinh bởi tế bào hình sao, là một chất đối kháng nội sinh đã được đặc trưng rõ đối với endothelin. Trong nhiễm nội độc tố huyết cấp, sự sản sinh nitric oxide của tế bào hình sao tăng lên. Các nghiên cứu in vivo cho thấy carbon monoxide cũng làm trung gian cho sự giãn mao mạch hình sin thông qua tác dụng của nó trên tế bào hình sao .
e.Thoái biến chất cơ bản
Những thay đổi định tính và định lượng về hoạt tính của protease chất cơ bản đóng một vai trò quan trọng trong việc tu sửa chất cơ bản ngoại bào đi kèm tổn thương gan gây xơ hóa và sự thoái lui.
f.Mất retinoid và truyền tín hiệu thụ thể của nhân
Khi các tế bào hình sao hoạt hóa, chúng bị mất các hạt nhỏ retinoid quanh nhân đặc trưng (vitamin A) và có dạng nguyên bào sợi nhiều hơn. Trong nuôi cấy tế bào, retinoid được lưu giữ dưới dạng các ester retinyl, trong khi các tế bào hình sao hoạt hóa retinoid được phóng thích bên ngoài tế bào như retinol, cho thấy có sự thủy phân ester trong tế bào trước khi xuất . Tuy nhiên, chưa rõ liệu sự mất retinoid là cần thiết cho các tế bào hình sao để hoạt hóa hay không, và retinoid nào có thể thúc đẩy hoặc ngăn chặn sự hoạt hóa in vivo.
Một số thụ thể retinoid của nhân đã được xác định trong các tế bào hình sao . Loại phân tử này gắn kết với các ligand retinoid nội bào và điều hòa biểu hiện gen, nhưng không rõ chúng đóng vai trò điều hòa như thế nào trong sự gây xơ hóa. Câu hỏi này có ý nghĩa lâm sàng quan trọng, vì các phương pháp sử dụng retinoid trong trị liệu đang được xem xét (xem dưới đây).
Gần đây, peroxisome proliferator-activated receptors (PPAR), đặc biệt là PPARγ, đã được xác định trong các tế bào hình sao và biểu hiện của chúng tăng lên cùng với sự hoạt hóa. Các ligand đối với họ thụ thể của nhân mới được xác định này điều hòa giảm sự hoạt hóa tế bào hình sao. Tương tự như vậy, thụ thể farnesoid X (FXR) không chỉ điều hòa một loạt các gen tham gia vào sự tiết mật mà còn, ở các tế bào hình sao, có thể chi phối con đường chống xơ hóa đơn độc hoặc bằng cách tập trung về con đường truyền tín hiệu PPARγ . Ngược lại, các ligand PPARβ kích thích sự tăng sinh tế bào hình sao .
g.Con đường truyền tín hiệu viêm và sức hút hóa học đối với bạch cầu
Các tế bào hình sao được giả định ngày càng có một vai trò trung tâm trong sự hiểu biết của chúng ta về viêm gan. Chúng có thể làm tăng phản ứng viêm bằng cách gây thâm nhiễm bạch cầu đơn nhân, bạch cầu đa nhân, và chemokine được tiết bởi biểu mô ống mật có thể đẩy nhanh sự hoạt hóa tế bào hình sao trong ứ mật . Các tế bào hình sao được hoạt hóa sản sinh ra các chemokine bao gồm MCP-1, CCL21 RANTES và CCR5 . Chúng cũng biểu hiện thụ thể Toll-like (TLR) , cho thấy một khả năng tương tác với lipopolysaccharide của vi khuẩn và các ligand ngoại sinh khác bao gồm protein của virus có thể có và/hoặc acid nucleic. Sự hoạt hóa TLR kích thích các tế bào hình sao và một đặc điểm hoàn toàn của họ thụ thể này và vai trò tiềm năng của chúng trong sinh học tế bào hình sao được dự kiến.
Các tế bào hình sao cũng có thể hoạt động như các tế bào trình diện kháng nguyên , có thể kích thích sự tăng sinh tế bào lympho hoặc sự chết tế bào theo chương trình (apoptosis) . Các tế bào hình sao sản sinh những chất có sức hút hóa học đối với bạch cầu trung tính bao gồm cả CINC , có thể góp phần vào đặc điềm tích tụ bạch cầu trung tính trong bệnh gan do rượu.
Ngoài việc điều hòa hoạt động của bạch cầu, các tế bào hình sao đến lượt chúng có thể bị ảnh hưởng bởi các quần thể tế bào lympho đặc hiệu. Ví dụ, tế bào CD8 có hoạt tính gây xơ hóa đối với các tế bào hình sao nhiều hơn tế bào CD4 , có thể giải thích một phần về sự tăng xơ hóa gan tăng ở những bệnh nhân đồng nhiễm virus viêm gan C (HCV)/virus gây suy giảm miễn dịch ở người (HIV), trong đó tỷ lệ CD4/CD8 giảm, so với bệnh nhân nhiễm HCV đơn độc. Sự chết tế bào theo chương trình của tế bào hình sao ở gan thông qua sự kích thích của các tế bào diệt tự nhiên (NK) trong gan cũng đã được xác định và có thể làm giảm số lượng tế bào hình sao trong giai đoạn thoái lui xơ hóa .
4.Điều hòa phiên mã trong sự hoạt hóa tế bào hình sao
Đã có những tiến bộ đáng kể trong hiểu biết về sự điều hòa truyền tín hiệu nội bào và điều hòa gen phiên mã hoạt hóa ở các tế bào hình sao của gan được hoạt hóa .Một số lượng ngày càng tăng các yếu tố phiên mã và phân tử truyền tín hiệu có thể điều chỉnh cách hoạt động của tế bào hình sao, bao gồm p70S6K , PPARα, β và γ CRP-2 , thụ thể retinoid , NFκB , Jun D , yếu tố Kruppel-like 6 , Foxf1 , Lhx2 và MEF2 , trong số các loại khác .
IV.Cơ chế đặc hiệu đối với bệnh điều hòa sự xơ hóa gan – viêm gan nhiễm mỡ không do rượu (NASH) và virus viêm gan C (HCV)
Viêm gan nhiễm mỡ không do rượu liên quan đến một tỷ lệ ngày càng tăng của xơ hóa và xơ gan tiến triển với tỷ lệ tử vong tăng nhanh . Leptin, một hormone tạo mỡ trong tuần hoàn có nồng độ huyết thanh phản ánh khối lượng mỡ, đã có liên quan rõ rệt với sự gây xơ hóa tế bào hình sao và cần sự dẫn truyền thần kinh giao cảm . Các nguồn có thể là cả nội tiết và tự tiết (autocrine), kết hợp với tăng cường truyền tín hiệu thông qua thụ thể leptin, được điều hòa tăng khi hoạt hóa các tế bào hình sao .
Ngược lại với leptin, điều hòa giảm adiponectin trong bệnh béo phì, là một hormone điều hòa ngược, có thể làm tăng hoạt tính tạo xơ của leptin. Sự tiến bộ nhanh chóng trong hiểu biết của chúng ta về những adipokine này trong bệnh gan phản ánh tầm quan trọng ngày càng tăng của chúng trong xơ hóa gan, đặc biệt là viêm gan nhiễm mỡ không do rượu . Ví dụ, chuột nhắt thiếu adiponectin đã tăng sự xơ hóa sau tổn thương gan do nhiễm độc , và bệnh nhân bị viêm gan nhiễm mỡ không do rượu đã giảm biểu hiện của adiponectin và các thụ thể của nó .
Những tiến bộ trong sinh học về HCV đã phát hiện hoạt tính gây xơ hóa trực tiếp tiềm năng của virus. Các tế bào hình sao được hoạt hóa có thể bị nhiễm HCV vì chúng thể hiện là đối tượng của thụ thể virus, bao gồm CD80, thụ thể LDL và C1q . Ngoài ra, sự tải nạp adenovirus của protein không cấu trúc và lõi của HCV cảm ứng sự tăng sinh tế bào hình sao và phóng thích các tín hiệu gây viêm . Protein E2 của HCV có thể tương tác trực tiếp với CD81, một thụ thể màng huyết tương tế bào hình sao . Hơn nữa, các tế bào gan trong nuôi cấy tế bào hỗ trợ sự sao chép của HCV tạo ra yếu tố paracrine cũng kích thích các tế bào hình sao . Trong gan nhiễm HCV, chemokine và thụ thể của chúng được điều hòa tăng, kích thích sự tuyển mộ tế bào lympho .
Protein của HCV cũng có thể tương tác trực tiếp với tế bào nội mô mao mạch hình sin . Phản ứng tăng sinh ống mật nhỏ cùng với việc mở rộng khoảng cửa cũng tương quan với sự tiến triển xơ hóa . Nhiễm mỡ và chết tế bào theo chương trình trong nhiễm HCV có thể làm tăng xơ hóa , thậm chí ở những bệnh nhân không có viêm gan nhiễm mỡ không do rượu (NASH) và nhiễm mỡ đã xuất hiện như một yếu tố quyết định quan trọng của tiến trình xơ hóa trong nhiễm HCV .
V.Can thiệp bằng thuốc trong xơ hóa gan
Như vậy đến nay, chưa có loại thuốc nào được phê duyệt là thuốc chống xơ hóa ở người, mặc dù một số thuốc được dùng trong các thử nghiệm lâm sàng. Có một số cân nhắc cần thiết trong việc phát triển một loại thuốc chống xơ hóa an toàn, hiệu quả, được phê duyệt cho sử dụng trên lâm sàng: (i) các liệu pháp sẽ cần phải được dung nạp tốt qua các thập kỷ; (ii) phải nhắm đúng mục tiêu đến gan và ít tác dụng bất lợi trên các mô khác; (iii) các liệu pháp kết hợp có thể chứng minh tác dụng hiệp đồng hơn là tác dụng cộng, nhưng trước tiên các thuốc phải được kiểm tra từng thuốc riêng biệt để xác định độ an toàn và ‘bằng chứng về nguyên tắc’ (‘proof-of-principle’); (iv) chưa rõ liệu điều trị chống xơ hóa sẽ cần sử dụng cách quãng hoặc liên tục; (v) đối với những thuốc có khả năng có hiệu quả, phải xác định bằng chứng về tác dụng chống xơ hóa trực tiếp trong các mô hình thực nghiệm hơn là chỉ có tác dụng gián tiếp bằng cách làm giảm tổn thương chi phối đáp ứng tạo xơ; (vi) các liệu pháp dự tuyển phải có hiệu lực ở một gan đã bị tổn thương (như trong bệnh gan lâm sàng) hơn là chỉ trước khi khởi phát tổn thương; (vii) các liệu pháp chống xơ hóa cũng đem lại sự quan tâm về mặt lý thuyết là việc ức chế phản ứng tạo sẹo sẽ ngăn chặn việc bao bọc các vùng bị thương, dẫn đến mở rộng tổn thương mô. Tuy nhiên, trong thực tế các liệu pháp chống xơ hóa chỉ cần điều hòa giảm phản ứng sẹo để có hiệu quả và ở những bệnh nhân xơ gan thì việc tạo sẹo, không phải là tổn thương, thường dẫn đến suy gan.
1.Liệu pháp chống xơ hóa – cơ sở hợp lý và các thuốc đặc hiệu
Mô hình hoạt hóa tế bào hình sao đem lại một khuôn khổ quan trọng để xác định vị trí của liệu pháp chống xơ hóa (Bảng 1) .Chúng bao gồm: (i) chữa khỏi bệnh chính để phòng ngừa tổn thương; (ii) giảm viêm hoặc đáp ứng của vật chủ để tránh kích thích sự hoạt hóa tế bào hình sao; (ii) điều hòa giảm trực tiếp sự hoạt hóa tế bào hình sao; (iv) trung hòa đáp ứng tăng sinh, gây xơ hóa, co bóp và/hoặc đáp ứng tiền viêm của tế bào hình sao; (v) kích thích sự chết tế bào theo chương trình của tế bào hình sao; (vi) tăng thoái biến chất cơ bản của sẹo bằng cách kích thích tế bào sản sinh protease của chất cơ bản, điều hòa giảm các chất ức chế của chúng hoặc do sự dùng trực tiếp protease của chất cơ bản.
2.Chữa khỏi bệnh chính
Cách hiệu quả nhất để loại bỏ xơ gan là loại bỏ nguyên nhân chính của bệnh gan. Điều này bao gồm kiêng rượu trong bệnh gan do rượu, loại bỏ thừa sắt hoặc đồng trong bệnh nhiễm sắc tố sắt mô di truyền tiền xơ gan hoặc bệnh Wilson, làm sạch HBV hoặc HCV trong viêm gan do virus mạn tính, tiệt trừ các vi sinh vật trong bệnh sán máng hoặc giảm sức ép trong tắc ống mật cơ học. Sút cân không được xem nhẹ ở những bệnh nhân bị viêm gan nhiễm mỡ không do rượu hoặc ngay cả những người thừa cân nhiễm HCV, có thể cải thiện về mô học và là một khuyến nghị đơn giản. Tương tự như vậy, sự đảo ngược xơ hóa gan liên quan với nối tắt hỗng-hồi tràng jejunoileal và ngừng methotrexate cũng có thể ngăn chặn sự tiến triển đến xơ gan. Xác định cơ chế sinh bệnh của xơ gan mật nguyên phát và viêm đường mật xơ hóa nguyên phát có thể dẫn đến loại bỏ tổn thương ống mật và xơ hóa quanh ống mật.
Bảng 1 Can thiệp bằng thuốc hiện tại và đề nghị đối với xơ hóa gan.
Làm giảm tổn thương và viêm Làm giảm sự hoạt hóa tế bào hình sao Các đặc tính ức chế tế bào hình sao được hoạt hóa Thúc đẩy sự chết tế bào theo chương trình đặc hiệu của tế bào hình sao ở gan Thoái biến chất cơ bản của sẹo |
ACE: enzyme chuyển angiotensinogen (angiotensinogen-converting enzyme); AT: angiotensin; CCN: cysteine-rich 61/yếu tố tăng trưởng mô liên kết, u nguyên bào thần kinh biểu hiện quá mức; FXR: thụ thể farnesyl X (farnesyl X receptor); HGF: yếu tố tăng trưởng tế bào gan (hepatocyte growth factor); HMG CoA: 3-hydroxy-3-methyl-glutaryl coenzyme A; NGF: yếu tố tăng trưởng dây thần kinh (nerve growth factor); NOV: u nguyên bào thận biểu hiện quá mức (nephroblastoma overexpressed); PDGF: yếu tố tăng trưởng có nguồn gốc tiểu cầu (platelet-derived growth factor); PDTC: pyrrolidine dithiocarbamate; PPAR: thụ thể hoạt hóa tăng sinh peroxisome (peroxisome proliferatoractivated receptor); Smad: mothers against DPP homologue 7; TIMP: yếu tố ức chế metalloproteinase ở mô; TGF-β: yếu tố tăng trưởng chuyển dạng beta.
3.Giảm viêm và đáp ứng miễn dịch
Giảm xơ hóa đã được báo cáo ở những bệnh nhân nhiễm HCV được điều trị thành công bằng pegylated α-interferon và ribavirin , có lẽ thông qua tác dụng của chúng trên sự sao chép của virus và tổn thương gan. Sự làm sạch virus kéo dài có lẽ liên quan với sự thoái lui rõ rệt của xơ hóa, vì vậy theo dõi lâu dài những bệnh nhân được làm sạch HCV thành công có thể cho thấy sự đảo ngược bệnh đột ngột hơn ở những thời điểm ban đầu. Quan trọng hơn, một số tác dụng chống xơ hóa được quan sát thấy ngay cả khi không có sự làm sạch virus . Trong xơ hóa mật thử nghiệm, interferon-α cũng làm giảm xơ hóa , tăng khả năng về cơ chế chống xơ hóa trực tiếp ngoài tác dụng kháng virus của nó.
Một số thuốc có hoạt tính chống viêm in vitro và in vivo, có thể loại bỏ các tác nhân kích thích cần thiết cho sự hoạt hóa các tế bào hình sao. Corticosteroid đã được sử dụng trong nhiều thập kỷ để điều trị một số loại bệnh gan, đặc biệt là viêm gan tự miễn . Hoạt tính của chúng là thuốc chỉ có tác dụng chống viêm, không có tác dụng chống xơ hóa trực tiếp đối với tế bào hình sao. Thuốc đối kháng yếu tố hoại tử khối u (TNF) α, hoặc yếu tố điều chỉnh NFκB có một số lý do hợp lý, vì một số ngày càng tăng của các thuốc có hoạt tính sinh học đang được sử dụng trong các bệnh viêm mạn tính khác, đặc biệt trong viêm gan. Pentoxifylline có thể phát huy hoạt tính chống xơ hóa bằng cách điều hòa giảm sự truyền tín hiệu TNFα . Những nỗ lực khác để trung hòa các cytokine gây viêm bao gồm các thuốc đối kháng RGD (Arg-Gly-Asp), có thể hạn chế tổn thương miễn dịch .
Hệ renin-angiotensin cũng có thể làm tăng viêm qua việc tạo ra stress oxy hóa và do đó thuốc đối kháng enzyme chuyển và/hoặc thuốc đối kháng thụ thể angiotensinogen II type 1 có thể có hoạt tính chống viêm cũng như chống gây xơ hóa..
Acid ursodeoxycholic có một tác dụng có lợi trên sự xơ hóa trong xơ gan mật nguyên phát , có thể một phần là do hoạt tính chống viêm của nó. Tương tự như vậy, một dẫn xuất của acid ursodeoxycholic phóng thích nitric oxide làm giảm viêm, xơ hóa và áp lực tĩnh mạch cửa trong mô hình ở động vật .
Một nhóm các thuốc mới, được gọi chung là 'thuốc bảo vệ gan', cho thấy hứa hẹn đáng kể trong các nghiên cứu tiền lâm sàng và lâm sàng, bao gồm yếu tố tăng trưởng tế bào gan (HGF), các biến thể loại bỏ HGF và các chất tổng hợp có tác dụng tương tự HGF, cũng như yếu tố tăng trưởng giống insulin và một chất ức chế caspase phân tử nhỏ có thể cải thiện nồng độ aspartate aminotransferase (AST) ở bệnh nhân nhiễm HCV mạn tính và hiện đang nhiễm HCV trong các thử nghiệm lâm sàng . Cơ chế chính xác của hoạt tính chống xơ hóa chưa rõ ràng nhưng có thể bao gồm sự ức chế hoạt tính của TGF-β1 hoặc điều hòa tăng các protein tạo hình thái xương (BMP). Các thử nghiệm trên số lượng lớn động vật đang được tiến hành và các thử nghiệm trên người được dự kiến, với sự theo dõi cẩn thận được lên kế hoạch để tầm soát khả năng sinh ung thư biểu mô tế bào gan vì HGF là một mitogen tế bào gan.
4.Ức chế sự hoạt hóa tế bào hình sao
Giảm sự chuyển đổi tế bào hình sao không hoạt động thành nguyên bào sợi cơ được hoạt hóa là một mục tiêu đặc biệt hấp dẫn do vai trò trung tâm của nó trong các đáp ứng xơ hóa. Cách tiếp cận thực tế nhất là giảm stress oxy hóa, đó là một kích thích quan trọng đối với sự hoạt hóa. Các chất chống oxy hóa, bao gồm alpha-tocopherol (vitamin E) ức chế sự gây xơ hóa trong một số nghiên cứu nhưng không phải tất cả các nghiên cứu về sự gây xơ hóa trong thực nghiệm. Các chất chống oxy hóa khác cũng có thể làm giảm sự hoạt hóa tế bào hình sao trong nuôi cấy tế bào , cung cấp lý do hợp lý cho các thử nghiệm về chất chống oxy hóa ở người mặc dù, như đã nói ở trên, có thể cần đến các công thức mạnh hơn so với những công thức hiện có.
Silymarin, một thành phần flavonoid tự nhiên của milk thistle Silybum marianum, đã gây ra sự quan tâm như một liệu pháp chống xơ hóa tiềm năng. Các chức năng của hợp chất này như là một chất chống oxy hóa và có thể làm giảm tổn thương gan qua cả sự bảo vệ tế bào và ức chế chức năng tế bào Kupffer . Một thử nghiệm duy nhất trên người về xơ gan đã báo cáo một lợi thế sống còn nhẹ trong xơ gan do rượu ở những bệnh nhân xơ gan Child A , nhưng các nghiên cứu lớn hơn được kiểm soát cẩn thận đang được tiến hành để đánh giá hiệu quả của nó.
Interferon-γ là cytokine đã xác định có tác dụng ức chế sự hoạt hóa tế bào hình sao trong các mô hình xơ hóa ở động vật. Một thử nghiệm lâm sàng về interferon-γ không cho thấy lợi ích chống xơ hóa dự kiến ở những bệnh nhân nhiễm HCV, tuy nhiên có thể bởi vì chỉ những bệnh nhân bị xơ hóa tiến triển mới được đưa vào nghiên cứu và thời gian điều trị (1 năm) có thể là quá ngắn.
Interferon alpha, ngoài tác dụng kháng virus còn có thể điều hòa giảm sự hoạt hóa tế bào hình sao và sự gây xơ hóa trực tiếp thông qua con đường phân tử đã được xác định rõ và ức chế sự xơ hóa trong thực nghiệm . Các thử nghiệm với interferon-α dài hạn, liều thấp ở những bệnh nhân nhiễm HCV không đáp ứng, bao gồm cả HALT-C một phần được dựa trên cơ chế tác dụng này và, nếu các thử nghiệm trên thành công, loại thuốc này có thể nổi lên như là thuốc chống xơ hóa thực sự (bona fide)đầu tiên ở người. Sự ức chế biểu hiện gen collagen trong các mô hình thực nghiệm cũng có thể được thực hiện bằng cách sử dụng olignucleotide tổng hợp để ức chế hoạt tính của collagen promoter .
Một sự kích thích lớn đã được tạo ra bởi một thử nghiệm không đối chứng về IL-10, đã báo cáo tác dụng chống xơ hóa ở bệnh nhân nhiễm HCV tiến triển . Phát hiện này đặc biệt thú vị vì các nghiên cứu song song về tế bào hình sao ở động vật và tế bào hình sao được nuôi cấy cho thấy hoạt tính chống xơ hóa trực tiếp đối với thuốc này . Tuy nhiên, một thử nghiệm lâm sàng có đối chứng cho thấy không có lợi ích, có thể do thuốc làm tăng tải lượng virus HCV rõ rệt .
Các thụ thể của nhân PPARγ được biểu hiện trong các tế bào hình sao, và các ligand PPARγ tổng hợp (thiazolidinedione) điều hòa giảm sự hoạt hóa tế bào hình sao . Do việc sử dụng rộng rãi trong bệnh đái tháo đường, các thiazolidinedione thế hệ thứ hai và thứ ba (tức là không có độc tính đối với gan đã gặp với các thuốc thế hệ đầu tiên như troglitazone) đang được thử nghiệm trong các thử nghiệm lâm sàng ở cả viêm gan nhiễm mỡ không do rượu (NASH) và các bệnh gan xơ hóa khác. Ligand FXR dường như có tác dụng tương tự và các thuốc đồng vận phân tử nhỏ đang được nghiên cứu trong các mô hình tiền lâm sàng với các bằng chứng về hoạt tính chống xơ hóa .
Leptin được sản sinh bởi các tế bào hình sao được hoạt hóa, không những ảnh hưởng đến sự chuyển hóa lipid mà còn có thể ảnh hưởng trực tiếp đến sự làm lành vết thương. Trong thực tế, các động vật thiếu leptin đã giảm tổn thương gan và xơ hóa gan . Dựa trên kết quả này, việc khám phá ra adiponectin, một chất điều hòa ngược tự nhiên đối với leptin, có thể dẫn đến việc sử dụng thuốc này trong xơ hóa, đặc biệt là liên quan đến viêm gan nhiễm mỡ không do rượu .
Sự tiến bộ trong hiểu biết về điều hòa phiên mã đã cung cấp cơ hội để phong bế sự hoạt hóa tế bào hình sao bằng cách ức chế hoạt tính của histone deacetylase (HDAC) là enzyme quan trọng trong việc thay đổi chất nhiễm sắc trong sự phiên mã gen . Các chất ức chế HDAC đặc hiệu cao đem lại khả năng phong bế chọn lọc sự hoạt hóa tế bào hình sao với độ an toàn chấp nhận được và hiệu quả tốt , nhưng không có chất ức chế nào đạt được việc sử dụng trên lâm sàng. Tương tự như vậy, sự điều hòa các protein trong tế bào bao gồm các yếu tố phiên mã vẫn là một mục tiêu khó nắm bắt trong điều trị chống xơ hóa.
Liệu pháp thảo dược và các sản phẩm có nguồn gốc từ các hợp chất tự nhiên được sử dụng phổ biến ở vùng Viễn Đông đang ngày càng được thử nghiệm dưới các điều kiện nghiêm ngặt và khoa học, được kiểm soát , và cho thấy một số hứa hẹn về hiệu quả, đặc biệt là Sho-Saiko-To , salvia miltiorrhiza và polyphenol của trà xanh .
5.Trung hòa đáp ứng tăng sinh, gây xơ hóa, co bóp và/hoặc tiền viêm của tế bào hình sao
Những tiến bộ đáng kể về sinh học của yếu tố tăng trưởng sẽ giúp cho việc điều trị xơ gan thông qua việc phát triển thuốc đối kháng các cytokine và thụ thể của chúng. Đặc biệt, nhiều cytokine tăng sinh bao gồm tín hiệu PDGF, FGF và TGF-α thông qua các thụ thể tyrosine kinase, các chất ức chế đã trải qua thử nghiệm lâm sàng ở các mô khác . Do các đường dẫn tín hiệu nội bào đối với các thụ thể này đã được hiểu rõ, các chất ức chế mô hình truyền tín hiệu đang được nghiên cứu in vivo hoặc trong các tế bào hình sao được nuôi cấy, bao gồm các chất ức chế acid γ-linoleic và lipoxygenase và các chất ức chế con đường PPARγ (xem ở trên). Các chất ức chế khác bao gồm các chất ức chế HMG CoA reductase , pentoxifylline ức chế truyền tín hiệu thụ thể PDGF và các hợp chất làm tăng AMP vòng (cyclic adenosine monophosphate) hoặc phong bế chất vận chuyển ion, bao gồm perfenidone .
Sự thành công gần đây trong việc phát triển Gleevec, một thuốc đối kháng tyrosine kinase phân tử nhỏ có hiệu quả, an toàn trong bệnh bạch cầu ở người và các khối u tế bào trung mô , báo trước điều tốt về khả năng điều tri bằng phân tử nhỏ đường uống cho các chỉ định khác, bao gồm cả xơ gan. Trong thực tế, Gleevec là thuốc chống xơ hóa trong xơ gan thực nghiệm . Các phân tử nhỏ, trọng lượng phân tử thấp khác dùng đường uống để phong bế thụ thể cytokine hoặc truyền tín hiệu nội bào đang được phát triển. Một hợp chất như vậy là một chất ức chế chọn lọc về sự kết dính cục bộ qua trung gian Rho, có thể làm giảm xơ hóa gan thực nghiệm . Antisense RNA thông tin (mRNA) với chuỗi PDGF B cũng như các thụ thể PDGF beta âm tính trội hoặc hòa tan cũng phong bế sự hoạt hóa tế bào hình sao hoặc xơ hóa gan trong thực nghiệm . Khi công nghệ siRNA (RNA nhỏ can thiệp) công nghệ đã trở nên được áp dụng trên lâm sàng, phương pháp này cũng đáng được đánh giá thêm.
Sự ức chế sản sinh chất cơ bản là mục tiêu chính của hầu hết các liệu pháp chống xơ hóa cho đến nay. Điều này đã được thử trực tiếp bằng cách ngăn chặn sự tổng hợp và xử lý chất cơ bản hoặc gián tiếp bằng cách ức chế hoạt tính của TGF-β1 là cytokine gây xơ hóa chính. Các chất ức chế tổng hợp collagen như HOE 077, phong bế enzyme prolyl hydroxylase, nằm trong số các hợp chất chống xơ hóa đầu tiên được thử nghiệm ở gan, nhưng sự thành công với thuốc này là vừa phải. Tầm quan trọng mới xuất hiện của việc điều hòa phiên mã biểu hiện gen collagen có thể dẫn đến các chất ức chế phiên mã đặc hiệu có giá trị điều trị. Colchicine tạo ra sự phấn khích ở một thời điểm do hiệu quả rõ ràng của nó trong một nhóm nhỏ bệnh nhân ; tuy nhiên, một nghiên cứu thêm gần đây về xơ gan do rượu thấy không có lợi .
Thuốc đối kháng TGF-β đang được thử nghiệm rộng rãi vì sự trung hòa cytokine mạnh này sẽ có tác dụng kép ức chế sản sinh chất cơ bản và đẩy nhanh sự thoái biến của của nó . Các nghiên cứu trên động vật và nuôi cấy sử dụng các thụ thể TGF-β hòa tan hoặc các phương tiện khác trung hòa cytokine bao gồm kháng thể đơn dòng và chất ức chế protease để phong bế sự hoạt hóa TGF-β đã thiết lập ‘bằng chứng về nguyên tắc’ (‘proof-of-principle’) . Các lo ngại rằng việc ức chế TGF-β có thể làm thay đổi sự tăng trưởng của tế bào gan hoặc sự chết tế bào theo chương trình (apoptosis) sẽ cần được xem xét vì những thuốc đối kháng này đạt đến thử nghiệm lâm sàng nhưng, ở các mô khác, có hứa hẹn lớn đối với cách tiếp cận này. Một số thuốc đối kháng TGF-β hoặc ngay cả những thuốc đối kháng TGF-β mới hơn cũng đang được phát triển và có thể được thử nghiệm sớm. Những thuốc này có thể bao gồm Smad 7 tái tổ hợp, đối kháng hoạt tính của TGF-β ở các tế bào hình sao .
Rapamycin, một thuốc ức chế miễn dịch được sử dụng sau ghép gan, có lợi ích cộng thêm về việc ức chế sự tăng sinh tế bào hình sao có thể làm giảm bớt sự tiến triển tăng nhanh xơ hóa ở những bệnh nhân nhiễm HCV tái phát; tuy nhiên, sự hăng hái sử dụng rapamycin đã bị làm giảm đi do đã có báo cáo về sự tăng huyết khối động mạch gan .
Relaxin, một hormone peptide tự nhiên làm trung gian cho sự sinh đẻ, đã được phát triển như một thuốc làm giảm tổng hợp collagen bởi tế bào hình sao và làm tăng sự thoái biến chất cơ bản in vitro và in vivo . Tế bào hình sao cũng biểu hiện thụ thể relaxin mà có thể đại diện cho một mục tiêu hấp dẫn đối với sự đối kháng.
Do endothelin-1 là một yếu tố điều hòa quan trọng về sự co lại của vết thương và điều hòa lưu lượng máu qua trung gian tế bào hình sao, các thuốc đối kháng đã được thử nghiệm dưới dạng cả thuốc chống xơ hóa và thuốc làm giảm áp lực tĩnh mạch cửa. Bosentan, một thuốc đối kháng thụ thể A và B của endothelin hỗn hợp có hoạt tính chống xơ hóa và làm giảm sự hoạt hóa tế bào hình sao trong xơ hóa gan thực nghiệm . Thuốc đối kháng này và các thuốc đối kháng endothelin khác vẫn là mục tiêu phát triển thuốc hấp dẫn . Ngoài ra, sự phân phối nitric oxide vào gan bị tổn thương có thể có cùng hiệu quả điều trị là ức chế endothelin-1 .
Halofuginone, một hợp chất kháng cầu trùng, có hoạt tính chống xơ hóa bằng cách ngăn chặn biểu hiện collagen và đã được sử dụng trong một số mô hình xơ hóa mô, bao gồm cả gan .
Lợi ích tiềm năng của retinoid (vitamin A) như một liệu pháp chống xơ hóa bị hạn chế do sự hiểu biết không đầy đủ về vai trò điều hòa của chúng trong sự hoạt hóa tế bào hình sao và do mối lo ngại về độc tính. Mặc dù tế bào hình sao xuất retinoid khi chúng hoạt hóa, từ đây không suy ra rằng sự phục hồi của retinoid tế bào sẽ ngăn chặn sự hoạt hóa. Trong thực tế, một số retinoid có thể thúc đẩy sự xơ hóa bằng cách làm tăng tổn thương màng như trong chứng sử dụng quá liều vitamin A .
6.Kích thích sự chết tế bào hình sao theo chương trình
Sự chú ý đang ngày càng tập trung vào cách xơ gan thoái lui và đặc biệt là số phận của tế bào hình sao được hoạt hóa khi xơ hóa rút lui. Bằng chứng ngày càng tăng cho thấy có thể có cả sự đảo ngược phenotype của tế bào hình sao được hoạt hóa và sự chết tế bào theo chương trình. Đặc biệt, khi xơ hóa gan giảm, có sự chết tế bào chọn lọc của các tế bào hình sao được hoạt hóa . Sự quan sát thú vị này đã dẫn đến nghiên cứu trên động vật sử dụng gliotoxin kích thích sự chết tế bào theo chương trình có chọn lọc của các tế bào hình sao trong nuôi cấy và in vivo, dẫn đến giảm sự xơ hóa . Kháng thể trung hòa TIMP-1 có hoạt tính chống xơ hóa trong xơ hóa gan thực nghiệm . Tương tự như vậy, sự ức chế IKK, có tác dụng thực sự là để làm tăng sự truyền tín hiệu NFκB trong các tế bào hình sao, có thể đẩy nhanh sự chết tế bào theo chương trình . Sự chết tế bào theo chương trình cũng có thể được gây ra bởi sự gián đoạn sự kết dính qua trung gian integrin hoặc thông qua việc sử dụng các ligand TRAIL . Các tế bào hình sao có một số họ các chất trung gian của sự chết tế bào theo chương trình, bao gồm Fas/FasL, thụ thể TNF, thụ thể yếu tố tăng trưởng dây thần kinh và Bcl/Bax, do đó các mục tiêu bổ sung cho việc thúc đẩy sự chết tế bào theo chương trình sẽ có thể được thực hiện trong tương lai .
7.Tăng thoái biến chất cơ bản của mô sẹo
Thành phần này của việc điều trị rất quan trọng, vì liệu pháp chống xơ hóa trong bệnh gan của người sẽ cần thiết để kích thích sự tái hấp thu chất cơ bản hiện tại ngoài việc ngăn chặn sự lắng đọng ở sẹo mới. Như đã nói trên, thuốc đối kháng TGF-β có ưu điểm là kích thích sự thoái biến chất cơ bản bằng cách điều hòa giảm TIMPs và tăng hoạt tính thực sự của collagenase mô kẽ .Retinoid cũng có thể kích thích sự thoái biến chất cơ bản, nhưng những lo ngại về độc tính làm hạn chế lợi ích của chúng. Relaxin có thể trực tiếp làm tăng thoái biến chất cơ bản ..
Biểu hiện trực tiếp của metalloproteinase trong các mô hình động vật về xơ hóa gan đã bắt đầu khẳng định rằng chất cơ bản có thể được hấp thụ bởi biểu hiện của các enzyme ngoại sinh . Trong khi điều này dường như không thực tế ở người, các dữ liệu đã thiết lập một bằng chứng về nguyên tắc (proof-of-principle) quan trọng là chất cơ bản đáp ứng với sự thoái biến. Hơn nữa, một nghiên cứu thực nghiệm đã khẳng định tầm quan trọng của sự thoái biến chất cơ bản trong sự thoái lui xơ hóa gan bằng cách chứng minh rằng một chuột nhắt được biến đổi về di truyền biểu hiện collagen đột biến chống lại sự thoái biến cho thấy sự thoái lui xơ hóa chậm lại sau tổn thương gan..
VI.Kết luận
Trong khi triển vọng điều trị xơ hóa không phải là mới, các chiến lược hiện tại của liệu pháp chống xơ hóa được dựa nhiều hơn vào cơ sở hợp lý và cơ chế. Xem xét bằng chứng ngày càng tăng về sự thoái lui xơ hóa ở người sau khi điều trị thành công bệnh gan chính, sự tiến bộ tiếp tục là chắc chắn. Các liệu pháp sẽ ngày càng được điều chỉnh để lưu giữ genotype và các đặc điểm đặc hiệu của bệnh, và được sử dụng kết hợp. Các phương pháp xác định nguy cơ tiến triển xơ hóa và khả năng đáp ứng điều trị sẽ được thiết lập. Hai trở ngại ngay trước mắt nhất - sự phát triển các chẩn đoán tốt hơn để làm rõ các tiêu chí trong các thử nghiệm lâm sàng và sự cần thiết để xác định một chất chống xơ hóa có thể ngăn chặn hoặc làm thoái lui xơ hóa ngay cả khi bệnh chính không bị kìm hãm - sẽ là các mốc quan trọng đối với các thử nghiệm về liệu pháp chống xơ hóa trong tương lai.