 |
|
ĐIỀU TRỊ UNG THƯ BIỂU MÔ TẾ BÀO GAN (HCC)
Lựa chọn phương pháp điều trị ung thư biểu mô tế bào gan (HCC) tùy thuộc vào giai đoạn của bệnh, mức độ rối loạn chức năng gan và xơ gan. Hệ thống phân chia giai đoạn theo Hội ung thư gan lâm sàng Barcelona cung cấp một phác đồ mô tả các lựa chọn phương pháp điều trị có sẵn đối với mỗi giai đoạn của bệnh (Hình 1). Có một vài cuộc tranh luận xung quanh các chiến lược điều trị; những vấn đề này sẽ được đề cập, cùng với việc bổ sung thêm sorafenib vào trang thiết bị của các phương pháp trị liệu đối với ung thư biểu mô tế bào gan.
I.CÁC QUAN ĐIỂM ĐIỀU TRỊ:
1.Điều trị khỏi bệnh
Lựa chọn để điều trị ung thư biểu mô tế bào gan (HCC) với ý định chữa khỏi bệnh, mặc dù chỉ khả thi ở một thiểu số bệnh nhân, đã góp phần vào việc cải thiện rõ tỷ lệ sống còn ở cả hai phương thức phẫu thuật và ghép gan, với tỷ lệ sống còn 5 năm là 60-70%. Ước tính 10-15% bệnh nhân bị ung thư biểu mô tế bào gan là những đối tượng cho phẫu thuật cắt bỏ, và chỉ khoảng 5% đáp ứng các tiêu chuẩn để ghép gan. Phẫu thuật là một điều trị chuẩn chấp nhận được đối với ung thư biểu mô tế bào gan có thể cắt bỏ ở bệnh nhân có chức năng gan được bảo tồn. Có sự tranh luận xung quanh việc can thiệp phẫu thuật, với một số dữ liệu hỗ trợ cho việc sử dụng phương pháp ghép gan đối với dạng bệnh này do tỷ lệ tái phát thấp hơn. Tuy nhiên, tỷ lệ sống còn lâu dài tương tự ở cả hai nhóm bệnh nhân cắt gan và ghép gan, vì vậy có sự quan tâm về nguy cơ biến chứng lâu dài của trường hợp thứ hai thứ phát do suy giảm miễn dịch. Việc giảm thiểu nguy cơ khi phẫu thuật là một trọng tâm trong các thử nghiệm lâm sàng. Phương thức soi ổ bụng và phương thức cắt bỏ khối u bằng sóng radio ít xâm lấn đang được nghiên cứu và hiện nay đã được chấp nhận là những cách tiếp cận chữa khỏi bệnh để điều trị các ung thư biểu mô tế bào gan kích thước nhỏ. Một phương thức cũ hơn là tiêm ethanol xuyên qua da không được ưa chuộng nữa do các dữ liệu mới đây đã cho thấy phương thức này kém hơn so với cắt bỏ khối u bằng sóng radio ở những bệnh nhân có tổn thương ung thư biểu mô tế bào gan kích thước nhỏ.
Theo phương pháp cổ điển, ghép gan được dành cho những bệnh nhân có gan bị bệnh và gan xơ có thể cắt bỏ.Tổ chức UNOS (the United Network for Organ Sharing) giúp phân bổ số lượng hạn chế các cơ quan đúng chỗ có sẵn qua việc sử dụng một hệ thống thang điểm, được gọi là hình mẫu đối với bệnh gan giai đoạn cuối, giúp điều chỉnh sự phân bổ nguồn hiếm có này - là hạn chế chính đối với ghép gan. Ghép gan bị hạn chế trong phạm vi những bệnh nhân bị ung thư biểu mô tế bào gan không có hơn 1 khối u duy nhất có đường kính 5 cm hoặc nhỏ hơn, hoặc 2-3 khối u, mỗi u có đường kính 3 cm hoặc nhỏ hơn, không lan rộng đến các mạch máu chính và/hoặc không có bệnh di căn. Tỷ lệ sống còn toàn bộ 5 năm sau khi ghép gan có thể cao bằng 75%. Ghép gan từ người hiến tặng còn sống là một nguồn gan khác càng ngày càng có thế chấp nhận, mặc dù vẫn còn sự tranh luận. Cách tiếp cận điều trị này đem đến nguy cơ cho cả người hiến tặng và người nhận.
2.Điều trị bổ trợ đối với ung thư biểu mô tế bào gan
Đến nay, không có điều trị bổ trợ nào có lợi ích đã được chứng minh trong việc làm giảm nguy cơ tái phát sau phẫu thuật cắt bỏ, ghép gan hoặc cắt bỏ khối u bằng sóng radio (RFA). Trước đây, một vài thử nghiệm bổ trợ đã cho thấy kết quả khả quan ban đầu, nhưng những kết quả này không có khả năng tái lập. 2 lựa chọn điều trị bổ trợ cho ung thư biểu mô tế bào gan (HCC) đã từng được đánh giá kỹ lưỡng nhất là l-131 lipiodol và acyclic retinoid. Trong một nghiên cứu ngẫu nhiên ở 43 bệnh nhân, l-131 lipiodol là chất bổ trợ được dùng qua đường động mạch gan đã được so sánh với quan sát sau khi cắt bỏ ung thư biểu mô tế bào gan. Đã ghi nhận sự cải thiện về tỷ lệ sống còn không bệnh trung bình thiên về nhóm dùng l-131 lipiodol (57,2 tháng so với 13,6 tháng; P = .037). Mặc dù sự cải thiện tỷ lệ sống còn vào thời điểm trình bày dữ liệu ban đầu, nhưng sự theo dõi lâu dài về thử nghiệm này trong 10 năm không cho thấy lợi ích sống còn đối với những bệnh nhân được điều trị bằng l-131 lipiodol.
Trong một nghiên cứu ngẫu nhiên về thuốc acrylic retinoid so với giả dược sau phẫu thuật cắt bỏ ở 89 bệnh nhân, những người được điều trị bằng acrylic retinoid có tỷ lệ tái phát là 27% so với 49% ở những bệnh nhân dùng giả dược (P = .04) trong giai đoạn theo dõi 38 tháng.
Các dữ liệu từ thử nghiệm SHARP đã giúp xác định sorafenib là điều trị chuẩn đối với ung thư biểu mô tế bào gan không thể cắt bỏ. Sẽ phải mất vài năm trước khi có kết quả của thử nghiệm điều trị bổ trợ với nhiều dự đoán, chọn ngẫu nhiên các bệnh nhân để dùng sorafenib so với giả dược sau khi phẫu thuật, được tiếp theo bằng phương thức cắt bỏ khối u bằng sóng radio (RFA) nếu có thể được. Mặc dù tác dụng chống tạo mạch của sorafenib đã được thiết lập để ngăn chặn bất kỳ xu hướng tạo mạch nào sau phẫu thuật cắt bỏ khối u bằng sóng radio, trị liệu này không được khuyến cáo dùng bổ trợ ở ngoài sự tiến hành một thử nghiệm lâm sàng. Các bác sĩ cần chú ý đặc biệt đến các tác dụng phụ có thể có liên quan với sorafenib, kể cả nguy cơ xuất huyết nặng hiếm gặp nhưng có khả năng xảy ra.
3.Điều trị bệnh tiến triển tại chỗ
Hai nguồn cung cấp máu cho gan có xu hướng làm phát triển nhiều trị liệu tại chỗ nhắm có chọn lọc đến các tổn thương ung thư biểu mô tế bào gan (HCC) được tưới máu quá mức bởi động mạch gan thay vì nhu mô gan nền được tưới máu qua hệ thống tĩnh mạch cửa. Liệu pháp gây thuyên tắc mạch bằng hóa chất qua động mạch (TACA) được xem là một điều trị chuẩn có thể chấp nhận đối với ung thư biểu mô tế bào gan tiến triển tại chỗ mà không thể thực hiện được phẫu thuật cắt bỏ hoặc ghép gan. Điều này dựa trên kết quả của 2 thử nghiệm lâm sàng cho thấy lợi ích sống còn đối với liệu pháp gây thuyên tắc mạch bằng hóa chất qua động mạch cao hơn điều trị triệu chứng. Trong 1 thử nghiệm lâm sàng ở 112 bệnh nhân có ung thư tế bào gan không thể cắt bỏ, các bệnh nhân được chọn ngẫu nhiên đối với liệu pháp gây thuyên tắc nhẹ động mạch (tức là không phải hóa liệu pháp), gây thuyên tắc mạch bằng hóa chất qua động mạch (TCAE) sử dụng doxorubicin, hoặc điều trị hỗ trợ tốt nhất. Điều trị bằng TACE dẫn đến lợi ích sống còn so với điều trị bảo tồn (tỷ lệ sống còn 1 năm: 82% so với 63%; tỷ lệ sống còn 2 năm: 63% so với 27%; P = .009. Theo ghi nhận, không có thử nghiệm lâm sàng nào chứng minh được sự khác biệt về tỷ lệ sống còn giữa bệnh nhân được điều trị bằng liệu pháp gây thuyên tắc nhẹ động mạch và bệnh nhân được điều trị bằng TACE. Một nghiên cứu thứ hai chọn ngẫu nhiên bệnh nhân đối với liệu pháp TACE sử dụng cisplatin so với điều trị triệu chứng đã cho thấy lợi ích sống còn tương tự thiên về nhóm TACE (tỷ lệ sống còn 1 năm: 57% so với 32%; tỷ lệ sống còn 2 năm: 31% so với 11%; tỷ lệ sống còn 3 năm: 26% so với 3%; P = .002. Tuy nhiên, các kết quả khả quan này không được tái lập ở các thử nghiệm khác.. Một phân tích tổng hợp bao gồm 2466 bệnh nhân từ các thử nghiệm ngẫu nhiên có đối chứng đã được tiến hành từ năm 1980 đến 2000 đã kết luận rằng TACE làm giảm đáng kể tỷ lệ tử vong toàn bộ sau 2 năm. Tuy nhiên, TACE không cho thấy có hiệu quả hơn liệu pháp gây thuyên tắc nhẹ động mạch. Hai phân tích tổng hợp khác mới đây báo cáo không có lợi ích sống còn đối với nhiều cách trị liệu tại chỗ khác nhau, kể cả TACE. Bất kể điều này, cả TACE và liệu pháp gây thuyên tắc nhẹ động mạch là những điều trị chuẩn được chấp nhận đối với những bệnh nhân bị ung thư biểu mô tế bào gan không thể cắt bỏ có ranh giới vùng.
II. ĐIỀU TRỊ TOÀN THÂN
Điều trị khỏi bệnh bằng phẫu thuật cắt bỏ và ghép gan là các lựa chọn được chỉ định đối với một thiểu số bệnh nhân bị ung thư biểu mô tế bào gan (HCC); hơn 80% bệnh nhân bị HCC có các khối u tiến triển và không thích hợp đối với những can thiệp chữa khỏi bệnh này. Ngoài ra, trong số những bệnh nhân đã trải qua trị liệu có khả năng chữa khỏi bệnh, tỷ lệ tái phát cao là 50% vào thời điểm 2 năm; vì vậy cần tiếp tục có các tiến bộ trong điều trị toàn thân.
1.Hóa liệu pháp
Các thuốc hóa trị đã được nghiên cứu rộng rãi trong điều trị ung thư biểu mô tế bào gan (HCC), với các thử nghiệm phase II cho tỷ lệ đáp ứng ở mức từ 10% đến 20% nhưng không bao giờ cho thấy sự cải thiện về tỷ lệ sống còn toàn bộ với điều trị hỗ trợ tốt nhất. Doxorubicin vẫn là thuốc được nghiên cứu rộng rãi nhất về HCC tiến triển, với tỷ lệ đáp ứng ở mức từ 0% đến 79%. Tỷ lệ đáp ứng mục tiêu với một thuốc đơn độc là doxorubicin trong 2 thử nghiệm phase III mới đây là 10,5% và 4%, dựa trên hình ảnh chụp X-quang có chụp cắt lớp điện toán, so sánh với các nghiên cứu trước đây đánh giá đáp ứng dựa trên khám thực thể hoặc chụp siêu âm. Hai thử nghiệm mới đây cho đánh giá chính xác nhất về hiệu quả của doxorubicin trong HCC. Các thuốc hóa trị khác đã được nghiên cứu trong điều trị HCC bao gồm docetaxel, paclitaxel,irinotecan, và gemcitabine; tuy nhiên không thuốc nào trong những thuốc này cho thấy bất kỳ lợi ích sống còn nào.
Do thiếu lợi ích sống còn khi điều trị bằng một thuốc đơn độc, các chế độ điều trị phối hợp đã được nghiên cứu rộng rãi đối với HCC. Một chế độ điều trị mạnh bằng PIAF (cisplatin, interferon alfa-2b, doxorubicin, và 5-fluorouracil) đã cho thấy một tỷ lệ đáp ứng là 26% và tỷ lệ sống còn trung bình khoảng 9 tháng trong một thử nghiệm phase II ở 1 nhóm. Ở nghiên cứu này, mặc dù với số lượng nhỏ bệnh nhân, được xem là một bước ngoặc cho trị liệu toàn thân đối với HCC vì 13 bệnh nhân (26%) có đáp ứng; trong số này, 9 bệnh nhân đã trải qua phẫu thuật và 4 bệnh nhân (9%) đã đạt được đáp ứng bệnh học hoàn toàn đối với hóa liệu pháp. Những kết quả này đã chứng tỏ là hóa liệu pháp đối với HCC có hiệu quả ở những bệnh nhân được chọn. Các kết quả khả quan này đã dẫn đến việc đánh giá PIAF trong một nghiên cứu ngẫu nhiên lớn so sánh với doxorubicin. Nghiên cứu này ở 188 bệnh nhân đã không đáp ứng tiêu chí đánh giá chính, với thời gian sống còn trung bình là 8,6 tháng đối với PIAF so với 6,8 tháng đối với doxorubicin (P= .83). Tỷ lệ đáp ứng quan sát được với PIAF không có ý nghĩa thống kê (20,9% đối với PIAF so với 10,5% với doxorubicin (P = .058). Các kết quả này hỗ trợ cho việc sử dụng PIAF ở dạng điều trị tân bổ trợ để phù hợp cho bệnh nhân về mặt y khoa có chức năng gan tốt là những người mà sự giảm số lượng tế bào ung thư có thể cho phép cắt bỏ trong tương lai. Khả năng chữa khỏi bệnh sẽ biện minh cho nguy cơ độc tính đáng kể của PIAF. Mặc dù cả hai chế độ hóa liệu pháp với một thuốc đơn độc và phối hợp đã không chứng minh được bất kỳ lợi ích sống còn nào trong điều trị HCC, nhưng việc sử dụng hóa liệu pháp phối hợp và trị liệu nhắm đích có tầm quan trọng do thành công của sự phối hợp trong điều trị các khối u đặc khác.
2.Đích phân tử trong ung thư biểu mô tế bào gan
Do việc thiếu điều trị chuẩn, các nhà nghiên cứu lâm sàng đã nhận ra nhu cầu bức thiết cần phải đánh giá các trị liệu mới đối với những bệnh nhân bị ung thư tế bào gan (HCC) tiến triển. Những nỗ lực này đã bắt đầu ở cùng một giai đoạn mà các nhà nghiên cứu khoa học cơ bản đang mô tả sự hiểu biết tốt hơn về cơ chế sinh ung thư tế bào gan và các quá trình liên quan. Những đích có tầm quan trọng trong HCC bao gồm các thụ thể của yếu tố tăng trưởng biểu bì và quá trình tạo mạch.
a. Chất ức chế thụ thể của yếu tố tăng trưởng biểu bì
Tầm quan trọng của chất ức chế thụ thể của yếu tố tăng trưởng biểu bì (EGFR) trong ung thư tế bào gan (HCC) vẫn đang được nghiên cứu. Tuy nhiên, một vài chất ức chế EGFR tyrosine kinase đã được nghiên cứu trong HCC. Erlotinib đã được nghiên cứu trong một thử nghiệm phase II ở 38 bệnh nhân bị ung thư tế bào gan tiến triển. Trong số những bệnh nhân được đưa vào nghiên cứu, 47% đã được điều trị hóa liệu pháp trước đó, và 71% trong tất cả bệnh nhân có chức năng gan Child-Pugh A còn bù tốt. Tiêu chí đánh giá chính là tỷ lệ sống còn không bị bệnh tiến triển vào lúc 6 tháng, sử dụng Tiêu chuẩn đánh giá đáp ứng về khối u đặc (RECIST). Vào thời điểm 6 tháng, 32% bệnh nhân không bị bệnh tiến triển, với thời gian sống còn không bị bệnh tiến triển trung bình là 3,8 tháng. Chỉ có 3 trường hợp đáp ứng một phần và thời gian sống còn toàn bộ trung bình là 13 tháng. Có 3-4 trường hợp có độc tính thường gặp nhất là nổi ban da 13%, tiêu chảy 8% và mệt mỏi 8%. Nhuộm hóa mô miễn dịch để đánh giá sự biểu hiện của EGFR không liên quan với kết quả, điều này đồng nhất với các dấu chứng về các khối u đặc ác tính khác.
Mặc dù hoạt tính tiền lâm sàng của cetuximab trong HCC, không có dữ liệu lâm sàng nào được công bố về việc sử dụng thuốc này trong HCC. Lapatinib - một chất ức chế kép của EGFR tyrosine kinase 1 và 2 (HER2/Neu) cũng đã được nghiên cứu trong HCC. Trong một thử nghiệm phase II đánh giá lapatinib ở 30 bệnh nhân có HCC tiến triển, 2 trong số 17 bệnh nhân được đánh giá có đáp ứng một phần đã được xác định, và 8 bệnh nhân có bệnh ổn định. Thời gian sống còn không bị bệnh tiến triển trung bình thì ngắn 1,8 tháng, không thuận lợi khi so sánh với các dữ liệu trong y văn. Ngoại trừ để cải thiện tỷ lệ sống còn đã ghi nhận đối với erlotinib (nghiên cứu phase II nhỏ ở một viện nghiên cứu), những nghiên cứu đầu tiên này về các chất ức chế EGFR không cho sự hỗ trợ đầy đủ để có thể khuyến cáo sử dụng những chất này là thuốc đơn độc trong điều trị HCC. Điều quan trọng cần chú ý là không có nghiên cứu nào trong số này đánh giá tình trạng đột biến KRAS của những bệnh nhân được đưa vào các nghiên cứu này. Trong HCC, đột biến KRAS ít xảy ra và có thể tùy thuộc vào bệnh nguyên của bệnh.
b.Chất ức chế quá trình tiền tạo mạch
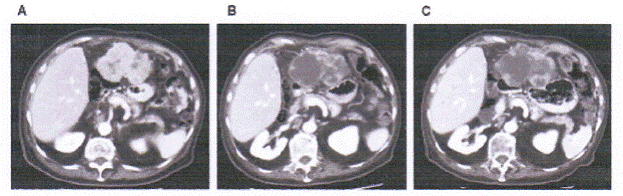
Sự tạo mạch bao gồm họ yếu tố tăng trưởng nội mô mạch máu (VEGF), là thành phần then chốt trong sự phát triển ung thư biểu mô tế bào gan (HCC). Trong các nghiên cứu tiền lâm sàng, VEGF được thấy làm tăng khả năng di căn của khối u của HCC. Khả năng di căn này được cho là bị chi phối bởi sự biểu hiện quá mức của thụ thể của yếu tố tăng trưởng beta có nguồn gốc tiểu cầu (PDGFR-β) trong HCC. Sorafenib, là một chất ức chế multityrosine kinase, nhắm đích là các VEGFR-1, VEGFR-2, và VEGFR-3 tạo mạch; PDGFR-β; và các thụ thể RET sinh khối u, Fit-3 và C-Kit. Sorafenib còn ức chế serine/threonine kinase Raf-1. Một thử nghiệm phase II của sorafenib ở 137 bệnh nhân bị HCC ở giai đoạn tiến triển đã cho thấy một tỷ lệ đáp ứng một phần thấp là 2%. Tuy nhiên, 33,6% bệnh nhân được điều trị có bệnh ổn định (≥ 16 tuần) phù hợp với thời gian đạt đến tiến triển về triệu chứng trung bình, có cải thiện tương đối và được xem xét độc lập là 5,5 tháng. Thời gian sống còn toàn bộ trung bình của nhóm nghiên cứu là 9,2 tháng, thuận lợi khi so sánh với các nhóm chứng về mặt mô học. Các độc tính độ 3/4 liên quan với việc điều trị bao gồm mệt mỏi (9,5%), tiêu chảy (8%), và phản ứng da ở bàn tay-bàn chân (5,1%). Có 1 sự cố xuất huyết nội sọ, tuy nhiên chưa rõ có phải phản ứng phụ này liên quan với thuốc hay không. Một quan sát chính trong nghiên cứu này là hoại tử khối u vùng trung tâm được ghi nhận ở các khối u của bệnh nhân có bệnh ổn định khác (Hình 2). Các đánh giá thêm đã cho thấy là sự hoại tử khối u cao hơn tỷ số thể tích khối u tương quan với đáp ứng mục tiêu. Hiện tượng các khối u mở rộng một ít và hoại tử đồng thời này cần được đánh giá về triển vọng. Tuy nhiên, các bác sĩ lâm sàng được khuyến khích sử dụng phương pháp chụp cắt lớp điện toán 3 pha (gồm cả phase động mạch) như một phương tiện để đánh giá thành phần hoại tử của sự đáp ứng.
Hình 2. Ví dụ tiêu biểu về chụp cắt lớp thường và chụp cắt lớp theo dõi hàng loạt chứng minh sự hoại tử khối u ở một bệnh nhân bị HCC.
 |
||
Thể tích (cm3) 285 Hoại tử (%) 51 |
295 2.1 |
341 53.1 |
Công bố đầu tiên bởi Hiệp Hội Ung Thư lâm sàng Mỹ. Abou-Alfa GK. Schwartz L, Ricci S và cộng sự. Phase II study of sorafenib in patients with advanced hepatocellular carcinoma. J.Clin Oncol. 2006; 24: 4293-4300.
Tiếp theo nghiên cứu phase II với sorafenib, SHARP là một thử nghiệm lớn mù đôi, ngẫu nhiên phase III đã đánh giá trị liệu bằng một thuốc đơn độc là sorafenib so với giả dược ở những bệnh nhân bị HCC tiến triển và xơ gan giai đoạn Child-Pugh A. Thử nghiệm này đối với hai tiêu chí đánh giá chính về tỷ lệ sống còn toàn bộ và thời gian đạt đến sự tiến triển về triệu chứng được đánh giá bằng Chỉ số Triệu chứng Gan-mật 8 - Đánh giá ung thư về chức năng - Thời gian đạt đến tiến triển về triệu chứng (FHSI8-TSP), cho thấy một sự cải thiện về thời gian sống còn là 10,7 tháng thiên về sorafenib so với 7,9 tháng đối với giả dược (tỷ số nguy cơ 0,69; P = .00058). Nghiên cứu này không cho thấy bất kỳ sự khác biệt nào về thời gian đạt đến tiến triển về triệu chứng (P= .77), là một quan sát có thể liên quan với các hạn chế của phương tiện đánh giá FHS18-TSP và điểm số tình trạng hoạt động cơ thể rất tốt của bệnh nhân được đưa vào nghiên cứu. Các dữ liệu về độc tính liên quan với thuốc nghiên cứu giống với các dữ liệu ghi nhận được trong nghiên cứu phase II, với 8% tiêu chảy và hội chứng bàn tay-bàn chân độ 3/4. Mặc dù ít gặp phản ứng phụ xuất huyết (< 1%), bác sĩ và bệnh nhân cần phải thận trọng về điểm này, xem xét đặc tính tạo mạch của sorafenib, cũng như với các thuốc kháng mạch khác.
Cục Quản lý Thực phẩm và Dược phẩm Mỹ, chủ yếu dựa trên các kết quả của thử nghiệm này, đã duyệt sorafenib cho những bệnh nhân bị HCC không thể cắt bỏ mà không có bất kỳ tham khảo đặc biệt nào về mức độ xơ gan. Mặc dù chỉ định rộng rãi này, độ an toàn và hiệu quả của sorafenib ở bệnh nhân Child-Pugh A hoặc cao hơn vẫn đang được đánh giá. Trong một nghiên cứu phase II đánh giá sorafenib trong HCC, 28% bệnh nhân có xơ gan giai đoạn Child-Pugh B. Ở 28 bệnh nhân được ghi nhận các thông số dược động học, các kết quả diện tích dưới đường cong (AUC) (0-8) tương đương giữa bệnh nhân bị bệnh giai đoạn Child-Pugh A (25,4 mg.giờ/L) và Child-Pugh B (30,3 mg.giờ/L). Nồng độ thuốc tối đa trong huyết tương (Cmax) cũng tương đương nhau (4,9 mg/L đối với bệnh nhân Child-Pugh A và 6 mg/L đối với bệnh nhân Child-Pugh B), với các dữ liệu về độc tính liên quan với thuốc tương tự nhau. Tuy nhiên, bệnh nhân Child-Pugh B có chức năng gan xấu đi thường gặp hơn, bao gồm cả tăng bilirubin huyết thanh; chưa rõ có phải sự hư hại này là tiến triển do thuốc hay do bệnh. Ngoài ra, sorafenib tác động như một cơ chất đối với UGT1A1, và nghiên cứu này đã không thu thập các số liệu đo bilirubin trực tiếp, vì vậy chưa rõ có phải tăng biliribin toàn phần có thể là do tác dụng ức chế UGT1A1 và giảm sự glucuronide hóa hay không. Thời gian đạt đến tiến triển về triệu chứng trung bình đối với bệnh nhân Child-Pugh A là 21 tuần và đối với bệnh nhân Child-Pugh B là 13 tuần. Thời gian sống còn toàn bộ trung bình đối với bệnh nhân Child-Pugh A là 41 tuần và đối với bệnh nhân Child-Pugh B là 14 tuần.
Cho đến khi đạt được các dữ liệu thêm về việc sử dụng sorafenib ở bệnh nhân bị HCC và xơ gan tiến triển, cần thận trọng khi áp dụng các kết quả của thử nghiệm SHARP cho những bệnh nhân bị xơ gan giai đoạn Child-Pugh B hoặc Child-Pugh C. Một nghiên cứu CALGB đánh giá việc sử dụng sorafenib ở 150 bệnh nhân bị rối loạn chức năng cơ quan đã cho hiểu biết thêm về việc sử dụng sorafenib ở những bệnh nhân này. Độc tính làm hạn chế sử dụng thuốc được báo cáo thường gặp nhất trong số những bệnh nhân có bilirubin ở mức cơ bản tăng là sự tăng thêm của bilirubin. Theo ghi nhận, nghiên cứu này không bị giới hạn đối với HCC (N=17), vì vậy chưa rõ sự liên quan và ý nghĩa của các dấu chứng đối với HCC. Tuy nhiên khuyến cáo được đề nghị liên quan với liều dùng sorafenib từ nghiên cứu này là: 400 mg, 2 lần/ngày đối với bệnh nhân có nồng độ bilirubin gấp 1,5 lần giới hạn trên của mức bình thường (x ULN) và 200 mg, 2 lần/ngày (hoặc 400 mg/ngày dùng đường uống) đối với bệnh nhân có nồng độ bilirubin gấp 1,5 – 3 ULN. Không có liều an toàn của sorafenib được thiết lập đối với bilirubin > 3 x ULN.
Một tình trạng khó xử khác liên quan đến các dữ liệu mới đây đối với sorafenib ở HCC là do kết quả của một nghiên cứu phase III ngẫu nhiên đánh giá sorafenib so với giả dược ở các nước Đông Nam Á.Đã ghi nhận được một lần nữa về sự cải thiện có ý nghĩa thống kê (P = .014) về thời gian sống còn thiên về sorafenib so với giả dược (6,5 tháng so với 4,2 tháng) nhưng không có tầm quan trọng tương tự thử nghiệm SHARP. Nghiên cứu này bao gồm những bệnh nhân có điểm số tình trạng hoạt động cơ thể kém và bệnh tiến triển thêm so sánh với những người tham gia thử nghiệm SHARP. Những sự khác biệt này có thể quy cho việc giảm lợi ích ở nhóm sorafenib giữa 2 nghiên cứu phase III. Dựa vào tỷ số nguy cơ đối với tỷ lệ sống còn toàn bộ, thời gian đạt đến tiển triển về triệu chứng, thời gian sống còn không bị bệnh tiến triển giữa 2 nghiên cứu, người ta cho rằng lợi ích đối với sorafenib đã được quan sát sớm trong bệnh sử tự nhiên ở thử nghiệm SHARP, trong khi những bệnh nhân trong nghiên cứu Asia-Pacific có lợi từ dạng can thiệp này nhưng không cùng mức độ. Một giải thích khác đối với sự khác biệt về kết quả này có thể tùy thuộc vào bệnh nguyên của HCC ở những bệnh nhân trong mỗi nghiên cứu, vì 73% bệnh nhân tham gia vào nghiên cứu Asia-Pacific có viêm gan B là một yếu tố nguy cơ có sẵn so với 18% bệnh nhân trong thử nghiệm SHARP. Kết quả của 18% bệnh nhân có viêm gan B trong thử nghiệm SHARP chưa được báo cáo. Ngoài ra, những bệnh nhân tham gia vào thử nghiệm SHARP có virus viêm gan C (HCV) có thể đáp ứng tốt hơn với trị liệu bằng sorafenib. Trong một phân tích 1 nhóm phụ bệnh nhân bị HCC liên quan với HCV, đã ghi nhận là 93 bệnh nhân này được điều trị bằng sorafenib có lợi ích về thời gian sống còn trung bình là 14 tháng so với toàn bộ nhóm là 10,7 tháng. Ngược lại, nhóm HCV có đối chứng với giả dược không có bất kỳ lợi ích sống còn thêm nào hơn nhóm giả dược trong nghiên cứu, cho thấy tình trạng HCV có thể có ảnh hưởng rõ trên hiệu quả của sorafenib. Điều này không làm yếu đi tác dụng chống tạo mạch của sorafenib, mặc dù thuốc này có thể tạo ra một sự cải thiện khác biệt về kết quả ở những bệnh nhân có bệnh nguyên viêm gan virus khác nhau. Bất kể điều này, sorafenib vẫn được chỉ định đối với tất cả bệnh nhân có HCC không thể cắt bỏ bất chấp bệnh nguyên ung thư của họ.
Bevacizumab đã được nghiên cứu rộng rãi ở những bệnh nhân bị HCC tiến triển. Bevacizumab được nghiên cứu ở dạng một thuốc đơn độc với liều 5 mg/kg và 10 mg/kg. Trong số 46 bệnh nhân được điều trị, 6 bệnh nhân (13%) đạt được đáp ứng mục tiêu, và 65% bệnh nhân không bị bệnh tiến triển vào thời điểm 6 tháng. Thời gian sống còn không bị bệnh tiến triển trung bình là 6,9 tháng và thời gian sống còn trung bình là 12,4 tháng. Xuất huyết độ 3-5 xảy ra ở 11% bệnh nhân bao gồm một trường hợp tử vong thứ phát sau xuất huyết do giãn tĩnh mạch. Một nghiên cứu khác đánh giá một thuốc đơn độc bevacizumab trong HCC cho thấy các kết quả tương tự.[Malka 2007] Trong số 24 bệnh nhân có thể đánh giá được về đáp ứng, 3 bệnh nhân có đáp ứng một phần và 13 bệnh nhân có bệnh ổn định.
Sunitinib cũng đã được kiểm tra trong HCC. Trong số 34 bệnh nhân được điều trị bằng sunitinib 37,5 mg/ngày, 50% bệnh nhân có bệnh ổn định, với thời gian sống còn không bị bệnh tiến triển trung bình là 3,9 tháng và thời gian sống còn toàn bộ là 9,8 tháng. Các phản ứng phụ độ 3/4 thường gặp nhất bao gồm độc tính về huyết học, mệt mỏi và tăng transaminase. Có 2 trường hợp tử vong đã được báo cáo ở nghiên cứu này được quy cho tình trạng bệnh xấu đi và suy gan. Chụp cộng hưởng từ có tiêm thêm thuốc tương phản từ cho hình ảnh rõ nét (DCE-MRI) đã được thực hiện và cho thấy giảm nhanh rò rỉ mạch máu liên quan với việc dùng sunitinib. Tác dụng này rõ hơn ở bệnh nhân có sự tiến triển chậm. Một nghiên cứu khác đã đánh giá sunitinib với liều 50 mg/ngày ở 37 bệnh nhân bị HCC giai đoạn tiến triển và đã cho thấy các kết quả hứa hẹn tương tự. Tuy nhiên, những nghiên cứu này đã không chuyển sang giai đoạn hai như đã định do tỷ lệ đáp ứng thấp là 2,7% ở giai đoạn đầu của cuộc nghiên cứu. Ngoài ra, có 4 trường hợp tử vong được cho là liên quan với bệnh não gan, độc tính về huyết học, và xuất huyết do giãn tĩnh mạch có thể liên quan với thuốc. Mặc dù có những dấu chứng này, vẫn có sự quan tâm tiếp tục về giá trị của việc điều trị bằng sunitinib trong HCC; một thử nghiệm lâm sàng phase III đánh giá sunitinib so với sorafenib ở bệnh nhân bị HCC tiến triển đang được tiến hành (Thử nghiệm lâm sàng).
III. ĐIỀU TRỊ PHỐI HỢP
Các cách tiếp cận hứa hẹn hơn để cải thiện kết quả ở những bệnh nhân bị ung thư biểu mô tế bào gan (HCC) giai đoạn tiến triển phát xuất từ các trị liệu phối hợp thuốc chống tạo mạch với các chất sinh học hoặc hóa liệu pháp. Bevacizumab đã được nghiên cứu phối hợp với các thuốc hóa trị như gemcitabine và oxaliplatin trong một thử nghiệm phase II ở các nhóm đã được điều trị trước đây với tình trạng thực hiện tốt và HCC giai đoạn tiến triển.Trong số 30 bệnh nhân, 20% có đáp ứng mục tiêu và 27% có bệnh ổn định. Thời gian sống còn không bị bệnh tiến triển trung bình là 5,3 tháng và thời gian sống còn toàn bộ trung bình là 9,6 tháng. Các độc tính độ 3/4 thường gặp nhất là giảm bạch cầu/giảm bạch cầu trung tính, tăng transaminase, tăng huyết áp và mệt mỏi. Một nghiên cứu phase II khác đã đánh giá tính khả thi và hiệu quả của sự phối hợp bevacizumab, oxaliplatin, và capecitabine ở 30 bệnh nhân bị HCC giai đoạn tiến triển. Đã ghi nhận đáp ứng một phần ở 13,3% bệnh nhân và 76,6% có bệnh ổn định. Thời gian sống còn không bị bệnh tiến triển trung bình là 4,5 tháng và thời gian sống còn toàn bộ trung bình là 10,3 tháng. Bệnh thần kinh ngoại biên độ 2/3 liên quan với oxaliplatin xảy ra ở 28% bệnh nhân, và hội chứng bàn tay-bàn chân độ 2/3 liên quan với capecitabine đã được báo cáo ở 16% bệnh nhân. Có 3 trường hợp phản ứng phụ xuất huyết đã được ghi nhận ở nghiên cứu này: 1 trường hợp thủng dạ dày ruột và 2 trường hợp xuất huyết do giãn tĩnh mạch. Capecitabine và bevacizumab cũng đã được nghiên cứu trong HCC. Ở 25 bệnh nhân, tỷ lệ kiểm soát bệnh là 60%, thời gian sống còn không bị bệnh tiến triển trung bình là 4,1 tháng, và thời gian sống còn toàn bộ trung bình là 10,7 tháng. Độc tính độ 3 liên quan với điều trị thường gặp nhất là hội chứng bàn tay-bàn chân. Có 1 trường hợp xuất huyết do loét dạ dày đã được báo cáo.
Các dữ liệu hứa hẹn hơn đối với điều trị phối hợp là với bevacizumab và erlotinib. Những bệnh nhân bị HCC Child Pugh A hoặc B, và số điểm thực hiện ECOG 0-2, đã được điều trị bằng bevacizumab 10 mg/kg mỗi 2 tuần và erlotinib 150 mg/ngày. Tiêu chí đánh giá chính về tỷ lệ sống còn không bị bệnh tiến triển vào lúc 16 tuần là 62,5%, với thời gian sống còn không bị bệnh tiến triển trung bình là 39 tuần. Thời gian sống còn toàn bộ trung bình là 68 tuần và tỷ lệ đáp ứng là 25%. Độc tính độ 3/4 liên quan với thuốc thường gặp nhất là mệt mỏi (20%), tăng huyết áp (15%), tiêu chảy (10%), tăng transaminase (10%), và xuất huyết tiêu hóa (12,5%). Các kết quả khả quan của nghiên cứu này thuận lợi khi so sánh với các nhóm chứng về mặt mô học, bao gồm cả một thuốc đơn độc là sorafenib. Điều này hỗ trợ cho sự xác đáng về mặt sinh học của sự phối hợp trị liệu chống tạo mạch với một chất ức chế tyrosine kinase trong HCC và đáng được đánh giá thêm. Một nghiên cứu phase II ngẫu nhiên về erlotinib, bevacizumab và sorafenib hiện đang được tiến hành (Thử nghiệm lâm sàng).
Sorafenib cũng được đánh giá phối hợp với trị liệu sinh học và hóa liệu pháp thông thường. Một nghiên cứu phase I đã đánh giá sorafenib phối hợp erlotinib ở bệnh nhân có khối u đặc. Nghiên cứu này bao gồm 1 bệnh nhân bị HCC. Mặc dù các dữ liệu giới hạn ở HCC, có 1 nghiên cứu phase III ngẫu nhiên đang được tiến hành đánh giá sorafenib kết hợp với erlotinib so với sorafenib ở bệnh nhân bị HCC giai đoạn tiến triển (Thử nghiệm lâm sàng). Ngoài ra, có những kết quả hứa hẹn từ 1 nghiên cứu phase II ngẫu nhiên đánh giá doxorubicin kết hợp với sorafernib và doxorubicin kết hợp với giả dược. Tiêu chí đánh giá chính-Thời gian trung bình đạt đến tiến triển-là 9 tháng đối với nhóm doxorubicin và sorafenib và 5 tháng đối với nhóm doxorubicin và giả dược. Một nghiên cứu so sánh thăm dò thời gian sống còn toàn bộ giữa 2 nhóm cho thấy một sự khác biệt đáng kể là 13,8 tháng thiên về nhóm dùng doxorubicin và sorafenib so với 6,4 tháng đối với nhóm doxorubicin và giả dược (tỷ số nguy cơ: 0,51, P = .0129). Dữ liệu về độc tính tương tự giữa 2 nhóm nghiên cứu, với dữ liệu độc tính đối với doxorubicin và sorafenib dùng ở dạng một thuốc đơn độc phù hợp với các nghiên cứu đã được báo cáo trước đây. Các độc tính độ 3/4 bao gồm mệt mỏi (15% ở cả hai nhóm) và giảm bạch cầu trung tính (55% với doxorubicin và sorafenib so với 46% với doxorubicin và giả dược). Các độc tính liên quan với sorafenib bao gồm tiêu chảy độ 3/4 (11%) và hội chứng bàn tay-bàn chân độ 3/4 (9%) ở nhóm phối hợp; tuy nhiên có thêm rối loạn chức năng thất trái ở nhóm doxorubicin và sorafenib (tất cả các độ: 19%; độ 3/4: 2%). Những dữ liệu này cho thấy là tác dụng hiệp đồng tiềm năng giữa doxorubicin và sorafenib dẫn đến làm nặng thêm chức năng tim có thể xảy ra. Các anthracyline như doxorubicin tùy thuộc vào Ask-1 trong việc phát huy tác dụng gây chết tế bào theo chương trình. Ở các tế bào ung thư, sự hoạt hóa Raf-1 – là một đích của sorafenib qua trung gian bFGF, có thể kích thích một phức hợp giữa Raf-1 và Ask-1 ở mức ty lạp thể, dẫn đến ức chế hoạt tính của Ask-1 kinase và ngăn cản tác dụng gây chết tế bào theo chương trình qua trung gian stress của các anthramycine. Hoạt tính ức chế raf kinase khi dùng sorafenib có thể làm phóng thích Ask-1 và phục hồi hoạt tính gây chết tế bào theo chương trình của doxorubicin (Hình 3). Một thử nghiệm lớn phase III ngẫu nhiên đánh giá sự phối hợp sorafenib và doxorubicin so với sorafenib đơn độc sẽ bắt đầu tuyển chọn đối tượng tham gia và hy vọng xác định thêm sự hiệp đồng tiềm năng của dạng phối hợp này.
Hình 3 Vai trò của Raf-1 trong sự điều chỉnh Ask-1 gây chết tế bào theo chương trình
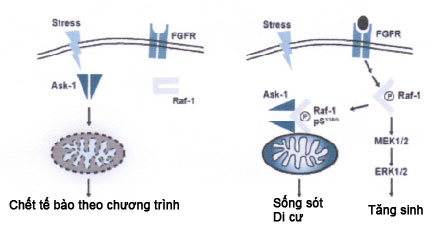
Được cho phép in lại từ Hình 6 trong tài liệu của Alavi AS, Acevedo L, Min W, Cheresh DA. Chemoresistance of endothelial cells induced by basic fibroblast growth factor depends on raf-1 mediated inhibition of the proapoptotic kinase, ASK1. Cancer Res. 2007;67:2766-2772.
IV.KẾT LUẬN
Ung thư biểu mô tế bào gan (HCC) là một vấn đề y tế toàn cầu và tỷ lệ mắc bệnh hiện đang tăng lên ở bán cầu phương Tây do dịch virus viêm gan C và tăng tỷ lệ mắc bệnh đái tháo đường và viêm gan nhiễm mỡ không do rượu. HCC là 2 bệnh trong 1 rối loạn chức năng gan có sẵn và chính bản thân ung thư, cả hai đều cần có sự điều trị tích cực. Hệ thống tính điểm không kết hợp cả rối loạn chức năng gan cũng như các yếu tố liên quan đến ung thư có giá trị khi thiết lập một chiến lược điều trị. Phẫu thuật, ghép gan, và trong một số trường hợp cắt bỏ khối u bằng sóng radio, là những phương thức chữa khỏi duy nhất đối với HCC, tuy nhiên những phương thức này chỉ có sẵn đối với một phần nhỏ bệnh nhân. Nguy cơ tái phát cao và thiếu trị liệu bổ trợ có hiệu quả cộng thêm vào nhu cầu bức thiết đối với điều trị toàn thân hiệu quả. Sorafenib hiện nay là một điều trị chuẩn đối với HCC giai đoạn tiến triển. Việc cải thiện kết quả khả quan này là một thách thức mới. Các hướng điều trị mới bao gồm phối hợp các thuốc chống tạo mạch với các thuốc sinh học khác như bevacizumab và erlotinib hoặc phối hợp với hóa liệu pháp như doxorubicin và sorafenib. Những cách tiếp cận này dường như là các hướng hứa hẹn nhất trong năm 2009 và đang được thử trong các thử nghiệm lớn phase III ngẫu nhiên.
Hình 1. Phân chia giai đoạn theo Hội ung thư gan lâm sàng Barcelona (BCLC).
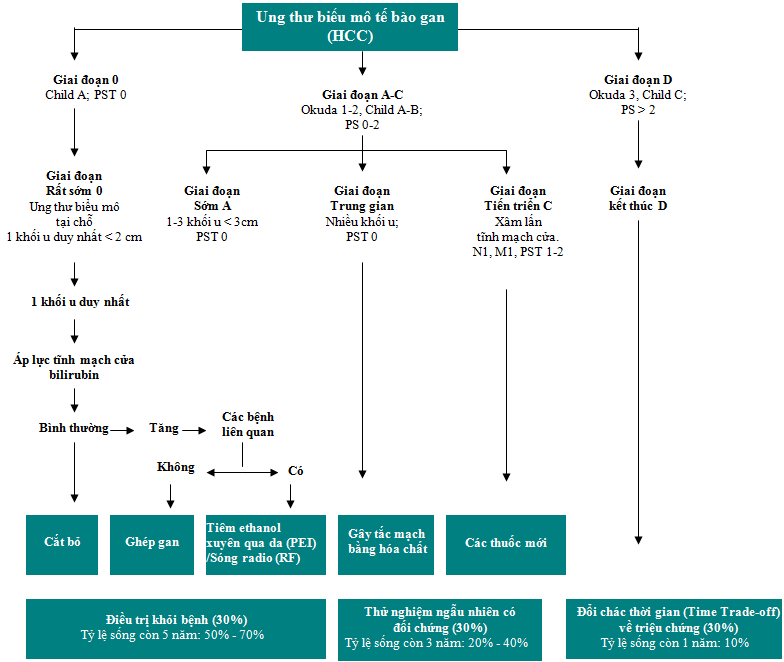
PEI: tiêm ethanol xuyên qua da; PS: tình trạng hoạt động cơ thể; PST: Kiểm tra tình trạng hoạt động cơ thể; RF: sóng radio; TTO: đổi chác thời gian
Bảng 1. Hệ thống thang điểm Child-Pugh trong bệnh gan
Đo |
1 Điểm |
2 Điểm |
3 Điểm |
Bilirubin (toàn phần), µmol/L (mg/dL) |
< 34 (< 2) |
34-50 (2-3) |
> 50 (> 3) |
Albumin huyết thanh, g/L |
> 35 |
28-35 |
< 28 |
Tỷ số chuẩn hóa quốc tế (INR) |
< 1,7 |
1,71 – 2,20 |
2,20 |
Cổ trướng |
Không có |
Được chặn lại |
Đề kháng |
Bệnh não gan |
Không có |
Độ 1-2 |
Độ 3-4 |
INR: Tỷ số chuẩn hóa quốc tế
Bảng 2. Phân chia giai đoạn theo thang điểm ung thư của chương trình gan Ý
(CLIP -Cancer of the Liver Italian Program)
Biến số |
0 Điểm |
1 Điểm |
2 Điểm |
Loại Child-Pugh |
A |
B |
C |
Hình thái học khối u |
1 khôi u duy nhất và |
Nhiều khôi u |
Khối u lớn hoặc |
Alfa-fetoprotein, ng/mL |
< 400 |
³ 400 |
|
Huyết khối tĩnh mạch của |
Không có |
Có |
|