 |
|
Quản lý sự thất bại điều trị trong viêm gan B mạn tính
Liệu pháp kháng virus đối với viêm gan B mạn tính vẫn còn là một thách thức về mặt lâm sàng. Mục tiêu chính của việc điều trị là phòng ngừa sự tiến triển của bệnh gan. Do cơ chế tồn tại dai dẳng của virus ở các tế bào gan bị nhiễm, liệu pháp kháng virus dài hạn là cần thiết ở đa số bệnh nhân. Sự ức chế virus không hoàn toàn và việc xuất hiện sự kháng thuốc là mối quan tâm lớn. Việc lựa chọn đúng một trị liệu mạnh đầu tay để đạt được sự ức chế sao chép virus duy trì dài hạn đem lại cơ hội tốt nhất để phòng ngừa sự thất bại điều trị và kháng thuốc. Các nghiên cứu lâm sàng đã chứng minh rằng những thuốc có rào chắn cao đối với sự đề kháng, như entecavir và tenofovir, có tỷ lệ đề kháng thấp hơn đáng kể khi so sánh với các thuốc có rào chắn thấp đối với sự đề kháng như lamivudine, adefovir hoặc telbivudine. Việc quản lý sự thất bại điều trị đòi hỏi theo dõi chính xác về lâm sàng và đúng đắn về mặt virus học cũng như can thiệp điều trị sớm bằng các thuốc bổ sung thích hợp đối với các dữ liệu đề kháng chéo của chúng. Việc giám sát dài hạn về hiệu quả điều trị và sự xuất hiện kháng thuốc có thể có là cần thiết đối với những bệnh nhân đã được điều trị theo trình tự với nhiều loại thuốc kháng virus. Cuối cùng, sự xác định các mục tiêu điều trị mới vẫn còn là một thách thức chủ yếu trong nghiên cứu để cải thiện hiệu quả của liệu pháp kháng virus hiện nay.
I.Những nguyên nhân chính để phát triển sự kháng thuốc của virus
Genome DNA chuỗi kép không hoàn chỉnh 3,2 kb của virus viêm gan B (HBV) được cấu tạo thành 4 khung đọc-mở gối lên nhau nhưng dịch chuyển khung (ORFs; Hình 1). ORF dài nhất trong số này mã hóa enzyme sao chép ngược (rt)-polymerase của virus (P ORF). ORF thứ hai, được gọi là ORF “vỏ bọc” hoặc “bề mặt” (S), mã hóa protein bề mặt của virus và được chứa trong P ORF. Hai ORF nhỏ hơn mã hóa các protein vùng trước lõi-protein lõi và protein X, tương ứng, cũng gối một phần lên P ORF. Vòng đời của HBV đã được hiểu tương đối rõ mặc dù thiếu các mô hình tế bào nhiễm virus mạnh và cho phép virus xâm nhiễm . Chiến lược sao chép của HBV bao gồm 2 bước chính. Đầu tiên, DNA vòng đóng đồng hóa trị (ccc) - nhiễm sắc thể nhỏ của HBV, hoạt động như một khuôn mẫu phiên mã chính đối với virus, vốn ổn định. Thứ hai, rt-polymerase của HBV dễ bị lỗi gây ra một tỷ lệ đột biến thay thế nucleotide cao, hình thành một quần thể gồm các biến thể virus hoặc các chủng biến đổi (quasispecies) có khả năng đáp ứng nhanh chóng với áp lực chọn lọc nội sinh (đáp ứng miễn dịch của vật chủ) và chọn lọc ngoại sinh (liệu pháp kháng virus hoặc trong quá trình lây truyền virus). Sự gộp các chủng biến đổi này dẫn đến tạo cho HBV một lợi thế sống còn do đã có sẵn từ trước một quần thể các thể đột biến thoát khỏi đáp ứng miễn dịch (escape vùng trước lõi hoặc HBeAg-escape), các vaccin dự phòng (vaccin escape), và liệu pháp kháng virus (kháng thuốc).
Trong những trường hợp bình thường, sự sao chép của HBV trong các tế bào gan nói chung không gây bệnh tế bào. Tuy nhiên, diễn tiến lâm sàng và kết quả việc sao chép liên tục của HBV được xác định bởi sự phát sinh và chọn lọc các thể đột biến virus thoát miễn dịch. Các nỗ lực không thành công thường xuyên do đáp ứng miễn dịch của vật chủ để loại bỏ các kiểu hoang dại và các thể đột biến của HBV thoát miễn dịch khỏi các tế bào gan bị nhiễm virus dẫn đến viêm hoại tử và tổn thương gan điển hình đi kèm với viêm gan B mạn tính (CHB) . Hơn nữa, việc sao chép HBV tích cực tương quan với bệnh gan hoạt động, và một số nghiên cứu lịch sử tự nhiên dài hạn từ châu Á gần đây đã thiết lập mối quan hệ trực tiếp giữa sự sao chép của HBV và các kết quả lâm sàng .
Các điều trị có hiệu quả đã được phát triển đối với viêm gan B mạn tính, làm giảm đáng kể tỷ lệ mắc bệnh và tỷ lệ tử vong. Hiệu quả điều trị có thể chịu ảnh hưởng bởi nhiều yếu tố như sự phát triển các tác dụng phụ, việc tuân thủ kém của bệnh nhân, điều trị trước đó bằng chế độ điều trị dưới mức tối ưu, nhiễm các chủng virus kháng thuốc, tiếp xúc với thuốc không đầy đủ do các đặc tính dược lý của các loại thuốc đặc biệt và biến dị di truyền của từng cá thể. Interferon (thông thường hoặc pegylated) và 5 thuốc khác thuộc nhóm các chất tương tự nucleos(t)ide (NA) đã được chấp thuận để điều trị viêm gan B mạn tính ở hầu hết các vùng trên thế giới . Các NA ức chế trực tiếp hoạt động phiên mã ngược của HBV polymerase. Các NA đã được chấp thuận bao gồm lamivudine (LMV), một chất tượng tự deoxy cytidine tổng hợp với cấu hình L không tự nhiên và L-nucleoside, telbivudine (LdT, β-L-thymidine) liên quan. Nhóm thứ hai, các acyclic phosphonate bao gồm adefovir dipivoxil (ADV), một tiền thuốc đối với acyclic 2’-deoxy adenosine monophosphate analog adefovir, và tenofovir tương tự về mặt cấu trúc (TFV). Nhóm thuốc thứ ba chứa một nửa đường D-Cyclopentane và có một thuốc kháng HBV mạnh nhất đã được tìm ra cho đến nay là deoxy guanosine analog entecavir (ETV) . Sự phân loại NA về mặt cấu trúc này hữu ích về lâm sàng vì nó giúp phân loại các kiểu và các con đường kháng thuốc NA (Bảng 1, Hình 1).
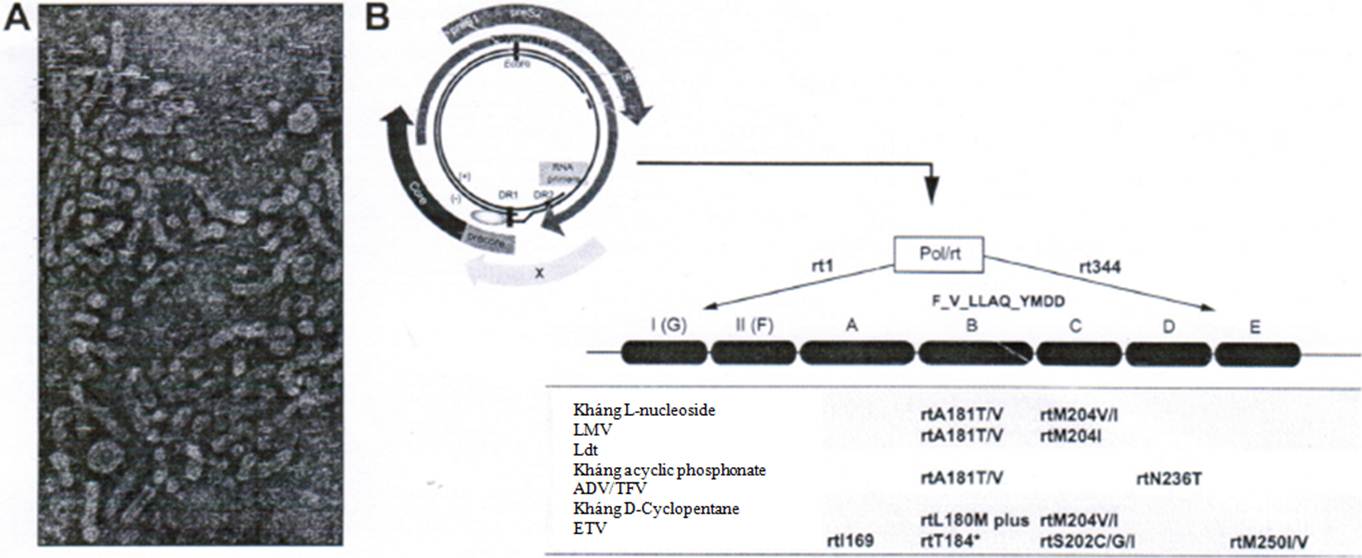
Hình 1. Cấu trúc của virus viêm gan B và genome của nó. (A) Ảnh hiển vi điện tử cho thấy HBV và các subviral particles. (B) DNA genome của HBV làm nổi bật polymerase/enzyme phiên mã ngược (Pol/rt) ở bên dưới được biểu thị đột biến thay thế kháng thuốc tiên phát liên quan đến các L-nucleoside (LMV và LdT), các acyclic phosphonate (ADV và TFV) và nhóm D-Cyclopentane (ETV). *S/A/I/L/G/C/M.
Bảng 1. Các kiểu đề kháng và con đường kháng thuốc kháng virus ở viêm gan B mạn tính trong bối cảnh kháng chéo.
Con đường |
Thay thế acid amin ở vùng rt |
LMV |
LdT |
ETV |
ADV |
TFV |
|
WT |
S |
S |
S |
S |
S |
L-nucleoside (LMV/LdT) |
M2041/V |
R |
R |
I |
S |
S |
Acyclic phosphonate (ADV) |
N236T |
S |
S |
S |
R |
I |
Chung (LMV, LdT, ADV) |
A181T/V |
R |
R |
S |
R |
I |
Nhân đôi (ADV, TFV) |
A181T/V + N236T |
R |
R |
S |
R |
R |
D-Cyclopentane (ETV) |
L180M + M204V/I ± I169 ± T184 ± S202 ± M250 |
R |
R |
R |
S |
S |
I: nhạy cảm trung bình; R:đề kháng; S:nhạy cảm dựa trên nuôi cấy tế bào và lâm sàng
Sự kháng thuốc kháng virus được định nghĩa là giảm tính nhạy cảm của virus đối với tác dụng ức chế của một thuốc và do quá trình đột biến thích nghi dưới áp lực chọn lọc liệu pháp kháng virus. Hai dạng đột biến đã được xác định: đột biến kháng thuốc tiên phát, trực tiếp chịu trách nhiệm đối với sự kháng thuốc liên quan, và đột biến thứ phát hoặc đột biến bù trừ. Dạng thứ hai xảy ra để tạo thuận lợi cho virus về khả năng sao chép, vì các đột biến kháng thuốc tiên phát có thể liên quan với giảm khả năng sao chép. Các đột biến bù trừ quan trọng vì chúng làm giảm các tác dụng có hại đối với virus liên quan với sự đạt được đột biến kháng thuốc tiên phát .
Sự phát triển kháng thuốc bắt đầu với các đột biến ở gene polymerase, tiếp theo bởi sự tăng tải lượng virus, tăng nồng độ alanine aminotransferase huyết thanh (ALT) trong vài tuần đến vài tháng sau, và sự tiến triển của bệnh gan (Hình 2A). Ở những bệnh nhân có đề kháng LMV, nguy cơ tăng ALT huyết thanh thường tương quan với thời gian có thể phát hiện chủng đề kháng . Những bệnh nhân này cũng có nguy cơ đáng kể về bùng phát ALT, có thể kèm theo mất bù gan . Tác dụng có hại của sự kháng thuốc của HBV về mô học gan và sau đó về kết quả lâm sàng đã được cho thấy bởi một thử nghiệm về LMV có đối chứng với giả dược ở bệnh nhân có sự xơ hóa tiến triển . Trái ngược với LMV, động học của sự xuất hiện đề kháng đối với ADV chậm hơn một cách điển hình (Hình 2B), nhưng chúng theo cùng một chuỗi sự kiện: các biến thể polymerase với các đột biến đề kháng đặc hiệu có thể được phát hiện ban đầu, tiếp theo bởi sự bùng phát virus và sau đó tăng các nồng độ ALT huyết thanh . Trong một số trường hợp, sự xuất hiện đề kháng ADV cũng đi kèm với đợt cấp của bệnh và suy gan.
Chỉ có dữ liệu hạn chế về kết quả lâm sàng của những bệnh nhân bị nhiễm HBV đề kháng LdT, ETV, hoặc TDF, chủ yếu do sự điều chỉnh điều trị, thường dựa trên dữ liệu đề kháng chéo in vitro, đã được bắt đầu sớm hơn nhiều. Sự có sẵn các thuốc kháng virus với dữ liệu đề kháng chéo bổ sung (Bảng 1) đã làm thay đổi việc quản lý bệnh nhân có kháng thuốc, cho phép bác sĩ phòng ngừa kết quả lâm sàng xấu đi do xuất hiện kháng thuốc. Có một số yếu tố nguy cơ về lâm sàng liên quan với sự phát triển kháng NA, bao gồm nồng độ HBV DNA huyết thanh cao, nồng độ ALT huyết thanh cao và chỉ số khối cơ thể cao . Điều trị trước với NA và sự ức chế virus không đầy đủ trong khi điều trị cũng dự báo sự kháng thuốc . Điển hình, sự phát triển kháng NA phụ thuộc vào 6 yếu tố: (1) cường độ và tốc độ sao chép của virus; (2) độ chính xác của polymerase của virus; (3) áp lực chọn lọc được phát huy bởi NA (hiệu lực); (4) số lượng khoảng không gian sao chép có sẵn trong gan; (5) khả năng sao chép của HBV kháng NA mới xuất hiện; và (6) rào cản di truyền đối với sự đề kháng NA. Những yếu tố này mới đây đã được xem xét và sẽ không được bàn luận chi tiết ở đây.
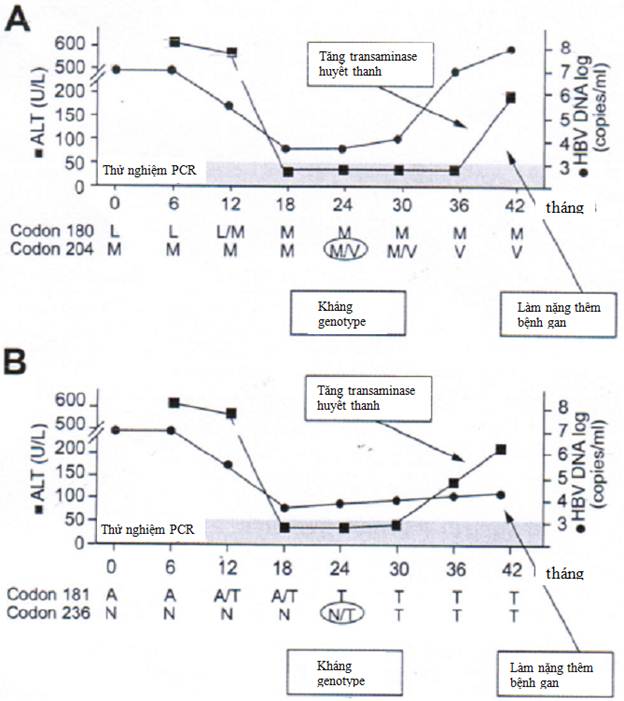
Hình 2. Mối liên hệ theo thời gian giữa tải lượng virus (HBV DNA), kháng genotype, và ALT huyết thanh trong suốt thời gian xuất hiện kháng thuốc ở các trường hợp điển hình của (A) lamivudine và (B) adefovir.
II.Các kiểu đề kháng nucleo(s)tide (NA) trong viêm gan B mạn tính
Các kiểu đề kháng khác nhau được trình bày theo sự phân loại của NA được trình bày ở trên.
A.Các L-Nucleoside
1.Các đột biến kháng lamivudine
Sự đề kháng thuốc kháng virus đối với LMV đã được vạch ra đối với tyrosine-methionine-aspartate-aspartate (YMDD) ở vị trí trên vùng xúc tác hoặc vùng C thuộc P ORF của HBV (Hình 1) . Các đột biến kháng thuốc tiên phát dẫn đến sự thay thế methionine bằng valine, isoleucine, đôi khi là serine, và là rtM204I/V/S được xác định. Mặc dù rtM204I có thể được tìm thấy một cách riêng biệt nhưng M204V/S chỉ được tìm thấy với các thay đối khác, đặc biệt là rtL180M (ở vùng B) [20, 21]. Các đột biến thay thế tiên phát khác cũng dẫn đến sự đề kháng LMV kể cả đột biến thay thế rtA181T/V . Những thay đổi bù trừ đã được tìm thấy ở các vùng khác của HBV P ORF như rtL80V/I , rtV173L và rtT184S .
Sự đề kháng LMV tăng dần trong thời gian điều trị với tỷ lệ từ 14% đến 32% hàng năm, vượt quá 70% sau 48 tháng điều trị . Cả hai đột biến kháng LMV (rtM204V/I và rtA181T) dẫn đến sự đề kháng chéo đối với LdT và các thành phần khác thuộc nhóm cấu trúc L-nucleoside như emtricitabine (FTC) và clevudine (L-FMAU) (xem Bảng 1). Đột biến thay thế rtM204V/I không dẫn đến sự đề kháng chéo đối với ADV hoặc TFV (xem Bảng 1), nhưng rtA181T/V đã được phát hiện trong thời gian điều trị với ADV [15, 25]. Điều quan trọng cần chú ý là rtM204V/I và rtL180M giảm tính nhạy cảm đối với ETV (xem Bảng 1).
2.Các đột biến kháng telbivudine
LdT là L-enantiomer “không tự nhiên” của (D-)deoxynucleoside tự nhiên của thymidine và được chuyển đổi một cách hiệu quả thành chất chuyển hóa triphosphate có hoạt tính với thời gian bán hủy nội bào dài. Các đột biến thay thế đề kháng chính ở HBV P ORF được tìm thấy với liệu pháp LdT là rtM204I, và điều này dẫn đến sự đề kháng chéo với thuốc kháng virus đối với LMV (xem Bảng 1). Các đột biến đề kháng đặc hiệu bổ sung đã được mô tả bao gồm rtA181T/V bằng con đường chung (Bảng 1, những đường chung) và rtL229W/V. Trong các nghiên cứu đăng ký telbividine, sự đề kháng với LdT đã tăng một cách ổn định từ 4% của các trường hợp hiện hành lúc 12 tháng đến trên 30% sau 24 tháng dùng đơn trị liệu.
B.Acyclic phosphonate
1.Các đột biến kháng adefovir
Sự đề kháng với ADV đầu tiên liên quan với các đột biến thay thế ở các vùng B (rtA181T) và D (N236D) của HBV P ORF. Sự đề kháng của HBV đối với ADV xảy ra ít thường xuyên hơn sự đề kháng với LMV, với tỷ lệ hiện mắc khoảng 2% sau 2 năm, dần đạt đến 29% sau 5 năm . Các đột biến liên quan với ADV này trong HBV P ORF dẫn đến kết quả chỉ giảm vừa phải tính nhạy cảm đối với ADV in vitro, và dẫn đến sự đề kháng chéo một phần đối với TFV (xem Bảng 1). rtN236T không ảnh hưởng đáng kể đến tính nhạy cảm đối với LMV , nhưng đột biến rtA181T dẫn đến sự đề kháng chéo đối với LMV và LdT (xem Bảng 1). Gần đây, một đột biến thay thế khác (rtI233V) đã được cho là dẫn đến sự đề kháng đối với ADV . Trong các nghiên cứu lâm sàng, sự thay đổi rtI233V dường như xảy ra khoảng 2% của tất cả bệnh nhân bị viêm gan B mạn tính nhưng vai trò chính xác của nó trong trường hợp ADV thất bại hoặc không đáp ứng chưa được thiết lập.
2.Các đột biến kháng tenofovir
TFV [9-(2-phosphonomethoxypropyl)adenine] liên quan chặt chẽ với ADV và cũng là một acyclic phosphonate của nucleotide, và giống như ADV, TFV cần một quá trình diphosphoryl hóa để chuyển đổi nó thành dạng hoạt động. TFV có hiệu quả chống lại cả HIV và HBV và đã được sử dụng thành công để điều trị những bệnh nhân đồng nhiễm virus. TFV, giống như ADV, cũng có hiệu quả chống lại virus kháng LMV với các thay đổi rtM204V/I. Như đã cho thấy ở Bảng 1, các đột biến tiên phát liên quan với sự đề kháng ADV (rtA181T/V và/hoặc rtA236T) có thể làm giảm hiệu quả của TFV cả in vitro [32] và in vivo . Trong hai thử nghiệm lâm sàng gần đây về TFV ở các bệnh nhân thất bại với ADV, mô hình phát triển virus huyết đôi khi khác nhau, với động học của sự giảm chậm hoặc nhanh, mặc dù sự hiện diện các đột biến đề kháng ADV tương tự ở mức cơ bản. Điều này có thể chỉ ra rằng tính biến đổi của genome virus ngoài những vị trí này có thể tác động đến sức mạnh của các thể đột biến này khi có sự hiện diện của TFV và động học của sự làm sạch virus. Trong nghiên cứu của Patterson và đồng nghiệp , HBV với đột biến kép rtA181T/V+rtN236T kháng lại việc điều trị cấp cứu bằng TFV (Bảng 1). Các nghiên cứu thêm về tác dụng của những đột biến thay thế này liên quan với ADV lên hiệu quả của TFV sau khi chuyển đổi là thật sự cần thiết.
C.Nhóm D-Cyclopentane
Các đột biến kháng entecavir
Sự đề kháng với ETV đã được mô tả đầu tiên ở những bệnh nhân bị nhiễm HBV đề kháng LMV . Đề kháng ETV đòi hỏi sự có mặt của rtM204V/I (± L108M) cộng với sự bổ sung các đột biến thay thế khác có “dấu ấn” ETV trên vùng B (rtI169T hoặc rtS184G), vùng C (rtS202G/I), hoặc vùng E (rtM250V) (Bảng 1). Khi không có rtL180M+rtM204V/I, rtM250V làm cho độ nhạy cảm với thuốc giảm đi 10 lần, trong khi sự thay đổi đơn thuần rtT184G và rtS202G/I ít có ảnh hưởng . Ngược lại, khi đột biến thay thế rtL180M+rtM204V cũng có mặt, đã quan sát thấy độ nhạy cảm với thuốc giảm đi hơn 100 lần. Gần đây, kháng ETV tiên phát ở một bệnh nhân chưa từng sử dụng NA đã được báo cáo và cần có ít nhất 3 đột biến thay thế cùng tồn tại, cho thấy một rào cản di truyền cao đối với ETV. Sự kháng ETV xảy ra ở bệnh nhân chưa từng sử dụng thuốc không đáng kể trong năm đầu và duy trì ở mức thấp (khoảng 1%) ngay cả sau hơn 6 năm điều trị [40]. Tuy nhiên, ở bệnh nhân kháng LMV và sau đó được chuyển sang ETV, tần suất bùng phát virus vào khoảng 50% , làm giới hạn vai trò của liệu pháp cứu chữa bằng ETV trên quần thể bệnh nhân này.
III.Các con đường dẫn đến đề kháng
Các đột biến thay thế kháng thuốc tiên phát liên quan đến sự thất bại của thuốc điều trị viêm gan B mạn tính được trình bày trong Bảng 1 và Hình 1. Cho tới nay, thay đổi 8 codon trong HBV P ORF giải thích cho thất bại điều trị ban đầu với NA đã được phê duyệt hiện nay đối với viêm gan B mạn tính. Các đột biến thay thế này dẫn đến sự tiến hóa của virus sau đó theo 5 con đường khác nhau:
IV.Kháng nhiều thuốc
Đơn trị liệu có thể thúc đẩy chọn lọc các chủng HBV kháng nhiều thuốc, đặc biệt khi bệnh nhân được điều trị theo trình tự với các thuốc có dữ liệu đề kháng trùng lặp, như LMV rồi sau đó đến ETV [41,42] hoặc LMV sau đó đến ADV hoặc ADV sau đó đến TFV [31] (xem Bảng 1). Phân tích clone cho thấy kháng nhiều thuốc thường xảy ra do sự thu nhận theo trình tự các đột biến kháng thuốc trên cùng một genome của virus. Các thể đột biến xuất phát từ quá trình chọn lọc này có thể đề kháng hoàn toàn với nhiều thuốc. Các nghiên cứu chỉ ra rằng chủng kháng nhiều thuốc có thể xuất hiện nếu chiến lược trị liệu “bổ trợ” không đem lại kết quả ngăn chặn virus nhanh, đặc biệt nếu có đủ không gian sao chép cho phép các thể đột biến lan rộng (tức là: hoạt động viêm hoại tử dẫn đến tăng sinh tế bào gan, hoặc gan ghép không được bảo vệ bởi HBIG do sự tồn tại từ trước của các thể đột biến thoát miễn dịch). Các phát hiện này nhấn mạnh việc cần thiết phải đạt được hiệu quả ngăn chặn virus hoàn toàn trong trị liệu kháng virus.
Đột biến thay thế một acid amin đặc hiệu có thể dẫn tới kháng nhiều thuốc (xem Bảng 1). Điều này được thấy với đột biến thay thế rtA181V/T, chịu trách nhiệm không chỉ giảm nhạy cảm với L-nucleoside LMV và LdT mà còn với acyclic phosphonate ADV và TFV . Điều này làm nổi bật sự hữu ích về lâm sàng của thử nghiệm genotype (thử nghiệm kháng thuốc) trên bệnh nhân đã thất bại với điều trị, như đã được thực hiện để quản lý điều trị HIV , nhằm phát hiện dữ liệu đột biến kháng virus và nhờ đó lập ra liệu pháp đối với chủng virus chính đang lưu hành.
V.Các khía cạnh lâm sàng của sự đề kháng và thất bại điều trị
Tất cả các bệnh nhân được nhận liệu pháp chất tương tự nucleo(s)tide (NA) để điều trị viêm gan B mạn tính cần được theo dõi cẩn thận về đáp ứng virus học và sự bùng phát virus trong quá trình điều trị, về khoảng thời gian đáp ứng và sự tái phát của virus sau khi ngừng điều trị . Nên kiểm tra HBV DNA huyết thanh mỗi 3 tháng trong quá trình điều trị , tuy nhiên nếu bệnh nhân tuân thủ điều trị và một rào cản di truyền cao, sử dụng thuốc có hiệu lực cao (ETV hoặc TFV), lúc đó tần suất này có thể giảm xuống. Lý do liệu pháp kháng virus thất bại tùy thuộc vào các cơ chế đặc hiệu, vì vậy các dấu hiệu và đáp ứng lâm sàng về mặt điều chỉnh điều trị sẽ khác nhau. Do đó, trên một bệnh nhân tuân thủ điều trị, điều quan trọng là phân biệt giữa không đáp ứng tiên phát, đáp ứng virus học một phần và bùng phát virus (sự tái hồi phục của virus) do sự kháng thuốc kháng virus tiềm ẩn.
1.Không đáp ứng tiên phát
Không đạt được giảm ít nhất 1,0log10 IU/ml tải lượng virus sau 12 tuần điều trị được xem là không đáp ứng tiên phát . Điều này có thể là do thiếu tuân thủ điều trị hoặc thuốc có thể không cho thấy hoạt tính kháng virus trên một cá thể riêng biệt. Đáp ứng dưới mức tối ưu đã được chứng minh là do tác dụng dược lý trên vật chủ và/hoặc sự tuân thủ điều trị của bệnh nhân nhưng không phải do tính nhạy cảm với thuốc của các chủng virus bị giảm như đã được đánh giá in vitro bằng định lượng phenotype . Với sự ra đời của các thuốc kháng virus mạnh hơn, như TFV và ETV, hiện tượng này - thường thấy với ADV, hiện nay ít gặp hơn. Khi nhận diện được không đáp ứng tiên phát, nên điều chỉnh trị liệu kháng virus để phòng ngừa sự tiến triển của bệnh và các nguy cơ theo sau về sự xuất hiện các quần thể đột biến kháng thuốc. Vì vậy thời điểm tuần thứ 12 của trị liệu quan trọng để xác định hoạt tính kháng virus của chế độ điều trị và đánh giá việc tuân thủ điều trị.
2.Đáp ứng một phần
Đáp ứng một phần tương ứng với việc không đạt được giảm tải lượng virus đến một ngưỡng cho thấy sự cải thiện mô học gan và nguy cơ kháng thuốc ở mức tối thiểu . Một trong các khuyến cáo của Hiệp Hội châu Âu đối với nghiên cứu các hướng dẫn thực hành lâm sàng về gan là đạt được nồng độ HBV DNA không phát hiện được trong thời gian điều trị; vì vậy, đáp ứng một phần được xác định bởi HBV DNA có thể phát hiện được bằng cách sử dụng thử nghiệm PCR theo thời gian thực trong thời gian điều trị liên tục .
Điều quan trọng cần chú ý là thời điểm để xác định đáp ứng một phần chưa được xác định chính xác. Thật vậy, với các thuốc kháng virus có hàng rào di truyền thấp đối với sự đề kháng (LMV, LdT), đáp ứng kháng virus ở tuần thứ 24 của việc trị liệu đã cho thấy dự đoán được tỷ lệ kháng thuốc sau đó. ADV ức chế nồng độ virus huyết với hiệu quả chậm hơn khi so sánh với các thuốc NA khác như LMV, ETV, LdT hoặc TFV. Vì vậy, thời điểm tuần thứ 48 được đề nghị sử dụng để dự đoán sự đề kháng với liệu pháp ADV, vì việc đánh giá tải lượng virus tại thời điểm này có thể dự đoán nguy cơ phát triển kháng thuốc theo thời gian . Với các thuốc mạnh hơn và có rào chắn di truyền cao như ETV và TFV, tỷ lệ HBV DNA không phát hiện được sau 1 năm trị liệu được cải thiện đáng kể, đạt 67% và 74% trên bệnh nhân HBeAg dương tính và 90% và 91% trên bệnh nhân HBeAg âm tính . Do tỷ lệ ức chế virus tiếp tục tăng theo thời gian với ETV và TFV, thời gian điều chỉnh điều trị chủ yếu tùy thuộc vào động học của sự phân rã tải lượng virus, đặc biệt ở bệnh nhân bắt đầu từ một tải lượng virus rất cao là những người có thể cần thêm vài tuần điều trị để đạt được nồng độ HBV DNA không phát hiện được bằng thử nghiệm PCR . Do đó, mô hình giảm tải lượng virus hữu ích hơn việc đánh giá đơn thuần tại một thời điểm đã định, vì điều thứ hai có thể dẫn đến diễn giải sai về đáp ứng điều trị. Mặc dù còn thiếu dữ liệu từ các nghiên cứu lâm sàng dài hạn, người ta khuyến cáo rằng trong các trường hợp nồng độ virus huyết thấp kéo dài hoặc khi nồng độ DNA HBV không tiếp tục giảm, việc điều trị nên được điều chỉnh phù hợp để tối đa hóa sự ức chế virus và giảm thiểu nguy cơ sau đó về sự xuất hiện đề kháng .
3.Bùng phát virus: sự tái hồi phục của virus
Bùng phát virus điển hình do sự xuất hiện các chủng virus kháng thuốc. Nó được xác định bằng sự tăng ít nhất 1,0log10 IU/ml so với trị số thấp nhất đạt được trong thời gian điều trị (nadir), được khẳng định bởi thử nghiệm thứ hai trên một bệnh nhân tuân thủ điều trị . Tùy thuộc vào dữ liệu đột biến được chọn lọc bởi thuốc đó, tải lượng virus có thể thấp làm cho việc chẩn đoán sự tái hồi phục của virus trở nên khó khăn (Hình 2B). Nó thường theo sau việc phát hiện đề kháng genotype (Hình 2A,B), tức là phát hiện đột biến kháng thuốc . Khi không có sự điều chỉnh điều trị cho phù hợp, sự tăng virus huyết có thể tiếp theo trong vài tuần hoặc vài tháng sau đó bởi sự tăng nồng độ ALT (bùng phát về sinh hóa) và bệnh gan tiến triển sau đó (bùng phát về lâm sàng). Sự tăng tải lượng virus liên quan đến sự xuất hiện các đột biến kháng thuốc tùy thuộc vào sức mạnh của các thể đột biến. Đáng chú ý là các đột biến kháng thuốc ở gen polymerase đã cho thấy ảnh hưởng đến gen bề mặt trùng lặp, có thể ảnh hưởng đến khả năng chúng được tiết ra từ các tế bào gan bị nhiễm hoặc đến tính nhiễm của chúng (xem Bảng 2). Điều này có thể dẫn đến sự tiến triển và tăng chậm của tải lượng virus (Hình 2B), trong đó nguyên tắc về tăng 1,0log10 IU/ml khó có thể áp dụng nếu việc theo dõi chính xác mỗi 3 tháng về tải lượng virus không được thực hiện .
Bảng 2. Những thay đổi vỏ bọc HBV (HBsAg) liên quan đến sự kháng thuốc kháng virus
Nhóm thuốc |
Đột biến kháng thuốc |
Các thay đổi HBsAg tương ứng |
|||
|
Acid amin |
Nucleotide |
|
||
L-nucleoside (LMV và LdT) |
rtL180M |
CTG |
® |
ATG |
Không thay đổi |
Acyclic phosphonate (ADV và TFV) |
rtA181T |
CTG GCN |
® |
CTG ACN |
sW172* |
D-Cyclopentan (ETV) |
rtL169T |
AT (A/T) |
® |
AC (A/T) |
sF161H/L |
VI.Phương pháp đánh giá đáp ứng và thất bại điều trị
1.Định lượng và theo dõi tải lượng virus
Đo tải lượng virus là cần thiết để theo dõi đáp ứng kháng virus cũng như xác định sự hiện diện của virus kháng thuốc, vì gần như tất cả các trường hợp kháng NA đều được nhận diện đầu tiên bởi sự tăng kéo dài tải lượng virus xảy ra mặc dù tiếp tục điều trị kháng virus. Thử nghiệm định lượng DNA HBV nhạy hiện nay đang được sử dụng sẽ phát hiện tải lượng virus đang gia tăng do virus kháng thuốc ngay cả khi sự xuất hiện của quần thể HBV kháng thuốc ở mức thấp. Do các yếu tố khác ngoài sự đề kháng thuốc (ví dụ: bệnh nhân tuân thủ điều trị kém và/hoặc các yếu tố dược lý bộ gen) có thể ảnh hưởng đến tải lượng virus, không thể tự động cho rằng tải lượng virus đang gia tăng biểu thị sự đề kháng thuốc bởi vì HBV kháng thuốc chỉ có thể được xác định bằng cách xác định genotype và/hoặc phenotype.
2.Phân tích di truyền: phân tích trình tự genome của virus/ phát hiện đột biến kháng thuốc
Để nhận diện sự đề kháng genotype tiềm năng, nucleotide và trình tự acid amin được suy ra của polymerase HBV được phân lập từ bệnh nhân trong quá trình bùng phát virus nên được so sánh với trình tự HBV phân lập được từ mẫu trước khi điều trị từ cùng một bệnh nhân . Khi không có các mẫu trước điều trị để phân tích, dữ liệu trình tự tại thời điểm bùng phát virus nên được so sánh với các trình tự được đồng thuận đã công bố của cùng genotype của HBV .
Xác định genotype tùy thuộc vào việc giải trình tự DNA hoặc sự lai. Các phương pháp dựa vào sự giải trình tự bao gồm phản ứng chuỗi polymerase (PCR) dựa trên nhóm dân số chuẩn, xác định clone của sản phẩm PCR và phân tích đa hình đoạn cắt giới hạn.
3.Giải trình tự quần thể
Giải trình tự DNA dựa trên PCR trực tiếp có thể phát hiện một đột biến cụ thể chỉ khi nó hiện diện trên ³ 20% tổng gộp các chủng biến đổi . Xác định clon có thể khắc phục sự hạn chế này nhưng đòi hỏi phải phân tích số lượng lớn clone. Các phương pháp xác định clone cần nhiều sức lao động, đòi hỏi nhân sự có kỹ năng cao, và không thích hợp để sàng lọc thông lượng cao. Ngoài thử nghiệm xác định genotype TRUGENE được phát triển bởi Visible Genetics (Siemens Healthcare Disgnostics, Tarrytown, NY), chưa có thử nghiệm định lượng dựa vào DNA nào có mặt trên thị trường hoặc đã được phê duyệt bởi các cơ quan đăng ký và vẫn còn là các thử nghiệm áp dụng “tại gia” thiếu sự chuẩn hóa.
4.Phát hiện/lai các đa hình đơn nucleotide (SNP)
Các ví dụ về phương pháp xác định genotype dựa trên sự lai là phương pháp có thể phát hiện sự bắt cặp sai của nucleotide đơn, bao gồm:
Một trong những hạn chế chính của các phương pháp dựa trên sự lai là độ đặc hiệu của chúng: đòi hỏi các bộ đoạn dò đặc hiệu mới cho mỗi thể đột biến, và tính biến thiên trình tự tự nhiên ở các vùng được quan tâm làm giảm khả năng phân biệt và tính đặc hiệu. Hơn nữa, bắt cặp trình tự và cấu trúc thứ cấp ở tế bào đích có thể ảnh hưởng độ nhạy, và một các quần thể phụ nhỏ (chiếm < 10% tổng quần thể) có thể không bị phát hiện.
5.Các nghiên cứu về các chủng biến đổi (quasispecies) và giải trình tự ultradeep
Pyrosequencing là phương pháp giải trình tự tương đối mới dựa vào sự phát hiện hoạt động của DNA polymerase bằng cách đo lượng pyrophosphate (PPi) được tiết ra bởi sự thêm dNMP vào đầu 3’ của đoạn mồi. Nó cho phép giải trình tự của một chuỗi đơn DNA bằng cách tổng hợp một chuỗi đơn bổ sung, một cặp base mỗi lần, và phát hiện base nào được thêm vào ở mỗi bước. Hiện tại, giới hạn chính của phương pháp pyrosequencing là chiều dài tối đa của mỗi trình tự riêng lẻ được giải mã ngắn hơn khi dùng phương pháp giải trình tự bằng phản ứng giới hạn chuỗi thường quy. Phương pháp pyrosequencing hiện nay là phương pháp nhạy nhất (0,1%) hiện có để phát hiện các quần thể phụ nhỏ của virus kháng thuốc và dường như trở thành phương pháp được lựa chọn trong tương lai, nếu như các dụng cụ đi kèm và quản lý thống kê sinh học nguồn dữ liệu trở nên dễ dàng hơn.
6.Phân tích phenotype và thử nghiệm đột biến chéo
Một số thử nghiệm đang được phát triển để thực hiện phân tích phenotype in vitro của các thể đột biến kháng thuốc đã được nhận diện in vivo trên bệnh nhân. Các thử nghiệm này rất cần thiết để xác định vai trò của dữ liệu đã có về đột biến trong đề kháng thuốc cũng như xác định dữ liệu về đề kháng chéo của các thể đột biến. Hai cách tiếp cận đặc biệt đã được sử dụng để nghiên cứu sự kháng thuốc của HBV: định lượng enzyme polymerase của virus và mô hình nuôi cấy tế bào để phân tích sự sao chép của virus .
Do các đột biến dẫn tới kháng NA ở tại gen polymerase virus, một số nhà nghiên cứu đã nghiên cứu tác động của chúng in vitro trong các phân tích trong môi trường phi tế bào về hoạt động của polymerase virus. Các mô hình chính để nghiên cứu hoạt động của polymerase HBV dựa trên biểu hiện của chúng trên tế bào côn trùng sử dụng vector baculovirus, và trên nghiên cứu về hoạt động của chúng trong phần nucleocapsid virus đã được tinh chế. Một mô hình thay thế cho các nghiên cứu polymerase HBV là sử dụng thử nghiệm trong môi trường phi tế bào cho biểu hiện của polymerase HBV trên vịt (DHBV) trong hệ thống lysate hồng cầu lưới. Nhìn chung, dữ liệu về đề kháng chéo đạt được trong thử nghiệm polymerase trong môi trường phi tế bào nói chung thống nhất với các dữ liệu đạt được trong thí nghiệm nuôi cấy mô; tuy nhiên một số điểm không nhất quán được quan sát thấy về mức độ tác động ức chế của các thuốc trên tổng hợp DNA của virus trong môi trường phi tế bào và trong môi trường nuôi cấy mô, cho thấy rằng chuyển hóa nội bào của các chất tương tự nucleos(t)ide có thể quan trọng khi xem xét đánh giá tổng quan về hoạt tính kháng virus của các hợp chất đặc biệt .
Một số mô hình nuôi cấy mô đã được phát triển để nghiên cứu sự kháng thuốc của HBV, hoặc để hiểu được cơ chế kháng các thuốc kháng virus hoặc để cung cấp dữ liệu đề kháng chéo. Các thử nghiệm này cũng cung cấp các dữ liệu quan trọng về sức mạnh của virus. Nguyên tắc của thử nghiệm là dựa trên sự phát tán của các clone HBV cDNA đột biến lây nhiễm vào dòng tế bào u gan bằng cách chuyển nhiễm nhanh hoặc phát tán vector baculovirus, hoặc trên sự hình thành dòng tế bào biểu hiện thường trực các thể đột biến kháng thuốc của HBV. Genome của thể đột biến có thể được tạo ra từ sự gây đột biến theo vùng hoặc bằng cách nhân bản các biến thể có trong tự nhiên. Tùy theo phương pháp luận được sử dụng, có thể xác định phenotype in vitro của một loài virus đơn độc hoặc hỗn hợp các loài đại diện cho các chủng biến đổi tự nhiên quan sát được trên bệnh nhân .
Do độ phức tạp về kỹ thuật và các hạn chế kèm theo của những thử nghiệm in vitro này, rất ít nghiên cứu được tiến hành in vitro để có được ý tưởng về tính nhiễm và độ mạnh của các thể đột biến kháng thuốc . Đây là một vấn đề quan trọng vì sự đột biến gen polymerase cũng có thể dẫn đến đột biến trên các gen bề mặt trùng lặp (Bảng 2). Sự kết hợp giữa polymerase và đột biến gen bề mặt có thể dẫn tới các virus biểu lộ độ mạnh giảm, điều này có thể hiểu là khác biệt về động học của chọn lọc. Tuy nhiên, các nghiên cứu như vậy bị cản trở bởi tính nhiễm thấp quan sát được ở các tế bào gan căn bản ở người và dòng tế bào HepaRG, hệ thống tế bào duy nhất có được để nghiên cứu chu kỳ sao chép virus đầy đủ, bao gồm cả sự nhiễm virus.
Các nghiên cứu in vivo về các thể đột biến kháng thuốc kháng virus có thể được thực hiện với DHBV trong mô hình loài vịt hoặc WHV trong mô hình loài macmôt (woodchuck); tuy nhiên, mô hình các đột biến thay thế liên quan đến kháng thuốc trong rt-polymerase có thể khác nhau giữa các loài. Nghiên cứu các thể đột biến kháng thuốc của HBV trên người chỉ hạn chế ở mức mô hình nghiên cứu trên tinh tinh và chuột nhắt với SCID từ người, nhưng dữ liệu còn hạn chế .
VII.Quản lý sự thất bại điều trị
Việc quản lý sự thất bại điều trị đã thay đổi đáng kể trong những năm gần đây. Thật vậy, với sự có sẵn các thuốc kháng virus mạnh và các công cụ theo dõi virus học, thất bại điều trị có thể mở rộng ra bao gồm cả đáp ứng virus học một phần cũng như sự bùng phát virus kinh điển. Trong tất cả trường hợp, cần kiểm tra cẩn thận sự tuân thủ điều trị, củng cố khi cần thiết và cần quản lý sự kháng thuốc kháng virus theo dữ liệu thử nghiệm kháng thuốc trên trình tự HBV Pol ADN đặc biệt của bệnh nhân, trong bối cảnh có dữ liệu về đề kháng chéo (Bảng 1).
1.Đánh giá sự tuân thủ điều trị
Tuân thủ tốt với liệu pháp kháng HBV rất quan trọng để duy trì sự ức chế tối đa sự sao chép của HBV. Tuân thủ điều trị trị kém có thể dẫn đến nồng độ thuốc trong huyết tương giảm đáng kể, tùy thuộc vào số liều bị bỏ sót và thời gian bán thải của thuốc, và có thể dẫn đến tăng sự sao chép của virus. Điều tra về sự tuân thủ liệu pháp NA trên bệnh nhân viêm gan B mạn tính cho thấy gần 40% có thể không tuân thủ điều trị hoàn toàn, điều này ảnh hưởng đáng kể đến tỷ lệ ức chế virus . Đáp ứng một phần với ADV cũng liên quan đến tuân thủ điều trị kém và các thông số dược lý khác, như tăng chỉ số khối cơ thể (BMI). Sự sao chép của virus ở mức thấp liên quan tới không tuân thủ điều trị làm tăng áp lực trên hiệu lực của NA, và kết quả làm tăng nguy cơ chọn lọc đề kháng. Bảng câu hỏi tuân thủ điều trị đặc hiệu và theo dõi nồng độ thuốc có thể hữu ích để quản lý bệnh nhân. Thật vậy, một nghiên cứu trên bệnh nhân nhiễm HIV được dùng thuốc kháng virus cho thấy dạng đường cong hình chuông về mối quan hệ giữa tuân thủ điều trị và đề kháng, tương tự với điều quan sát được giữa hiệu lực và đề kháng. Dữ liệu từ nghiên cứu này cũng gợi ý rằng sử dụng thuốc mạnh hơn có khả năng làm giảm thiểu tỷ lệ đề kháng trên bệnh nhân viêm gan B mạn tính không tuân thủ điều trị, cũng như tỷ lệ HIV RNA phát hiện được thấp hơn và sự đề kháng quan sát được trên bệnh nhân được sử dụng liệu pháp mạnh hơn, dù cho mức tuân thủ điều trị kém.
Đánh giá sự tuân thủ điều trị không dễ dàng trong thực hành lâm sàng. Các nghiên cứu đã cho thấy tuân thủ điều trị dựa trên tự báo cáo có thể được thổi phồng khi so sánh với đếm thuốc hoặc theo dõi điện tử (MEMS) về sự tuân thủ điều trị . Trình độ học vấn, loại bảo hiểm y tế, các yếu tố văn hóa cũng như chế độ đồng chi trả tiền thuốc có thể ảnh hưởng đáng kể đến sự tuân thủ điều trị. Tất cả các dữ liệu cho thấy vai trò quan trọng về sự giáo dục bệnh nhân và cung cấp hỗ trợ cho sự tuân thủ điều trị từ bệnh viện nhằm cải thiện hiệu quả của liệu pháp kháng virus trong thực hành lâm sàng.
2.Điều chỉnh điều trị theo đề kháng chéo
Đề kháng chéo được định nghĩa là kháng các thuốc mà virus chưa từng gặp do kết quả của các thay đổi đã được chọn lọc do sử dụng một thuốc khác (xem Bảng 1). Các đột biến liên quan đến kháng thuốc được chọn lọc bởi một NA riêng biệt gây ra ít nhất một mức độ đề kháng chéo đối với các thành viên khác trong cùng nhóm cấu trúc của nó nhưng cũng có thể làm giảm độ nhạy với NA từ một nhóm hóa học khác . Lựa chọn thuốc đầu tiên và liệu pháp cấp cứu sau đó cần dựa trên hiểu biết về đề kháng chéo , để cho thuốc thứ hai có dữ liệu về đề kháng khác với thuốc đã thất bại ban đầu . Điều này đặc biệt quan trọng vì các thể đột biến kháng thuốc đã được chọn lọc bởi những điều trị trước đó được cho là được lưu trữ trong kho dự trữ cccDNA của virus trong gan. Ưu điểm của việc áp dụng cách tiếp cận kết hợp bổ trợ bằng các NA với các dữ liệu đề kháng chéo bổ sung đã được nêu bật gần đây và một tóm tắt về các dữ liệu đề kháng chéo dựa trên cách tiếp cận bằng “các con đường” đề kháng của virus được trình bày trong Bảng 1. Ưu điểm của chiến lược bổ trợ là còn làm tăng rào cản đối với sự đề kháng và làm tăng hiệu lực của thuốc do đó làm cho sự phát triển kháng thuốc sau đó ít xảy ra hơn.
3.Quản lý sự kháng thuốc
Sự bùng phát virus trên bệnh nhân tuân thủ điều trị liên quan đến sự đề kháng của virus. Kháng thuốc có liên quan với điều trị trước đó bằng NA, hoặc ở các bệnh nhân chưa từng được điều trị với nồng độ HBV DNA ở mức cơ bản cao, nồng độ HBV DNA giảm chậm, và đáp ứng virus học một phần đối với điều trị. Cần xác định sự kháng thuốc càng sớm càng tốt, trước khi nồng độ ALT tăng lên, bằng cách theo dõi nồng độ HBV DNA và nếu có thể thì xác định dữ liệu về đề kháng NA; chiến lược điều trị tốt nhất sau đó có thể được quyết định dựa trên thông tin này. Các nghiên cứu lâm sàng và virus học đã chỉ ra lợi ích của việc điều chỉnh điều trị sớm (ngay khi tải lượng virus tăng lên) . Trong trường hợp đề kháng, cần bắt đầu một liệu pháp cấp cứu thích hợp và nên có hiệu quả kháng virus tốt nhất và nguy cơ thấp nhất về chọn lọc chủng kháng nhiều thuốc. Vì vậy, thêm một thuốc thứ hai không nằm cùng nhóm kháng chéo với thuốc đầu tiên (tức là L-nucleoside so với acyclic phosphonate so với D-Cyclopentane) là cách tiếp cận điều trị được khuyến cáo.
Tuy nhiên, mặc dù có một cơ sở virus học mạnh mẽ cho chiến lược bổ trợ với một thuốc bổ sung để phòng ngừa sự xuất hiện chủng virus kháng nhiều thuốc và dựng lên một rào cản đối với sự đề kháng, có khuynh hướng hiện tại khuyến cáo việc chuyển đổi qua một thuốc bổ sung có rào cản đối với sự đề kháng cao dựa vào quan sát lâm sàng tương đối ngắn hạn; các lựa chọn này đang được bàn luận trong những hướng dẫn của quốc gia và quốc tế khác nhau. Điểm quan trọng này sẽ cần một đánh giá chính xác bằng các nghiên cứu lâm sàng và virus học phân tử dài hạn. Hơn nữa, chiến lược chuyển đổi này không áp dụng cho những bệnh nhân đã dùng nhiều đơn trị liệu thay thế; những bệnh nhân này nên được tuyển chọn cho các chiến lược bổ trợ nhằm giảm thiểu nguy cơ thất bại điều trị sau đó.
Bảng 1 cho thấy dữ liệu đề kháng chéo đối với các biến thể HBV đề kháng thường gặp nhất . Điều chỉnh điều trị nên được tiến hành sao cho phù hợp và được tóm tắt như sau:
Lưu ý rằng độ an toàn của một số phối hợp về lâu dài hiện tại chưa được biết đối với viêm gan B mạn tính và liệu pháp bổ trợ không phải luôn luôn thành công trong việc đạt được ức chế virus đầy đủ như được chỉ ra bởi thử nghiệm PCR. Các khuyến cáo này được đưa ra trong bối cảnh của một kịch bản điều trị trong “thế giới lý tưởng”, nhưng cần phải được cân nhắc về phương diện chi phí và sự có sẵn của thuốc.
4.Xử trí không đáp ứng tiên phát và đáp ứng một phần
*Không đáp ứng tiên phát
Không đáp ứng tiên phát được quan sát thấy thường xuyên hơn ở bệnh nhân được điều trị với ADV (khoảng 10-20% bệnh nhân) so với bệnh nhân được điều trị với các NA khác, có lẽ do hiệu lực thấp của ADV . Bệnh nhân không đáp ứng với ADV nên được chuyển đổi càng sớm càng tốt sang liệu pháp TFV hoặc ETV. Không đáp ứng tiên phát đối với LMV, LdT, ETV hoặc TFV hiếm gặp ; trên các bệnh nhân này, quan trọng là xác định mức độ tuân thủ điều trị. Nếu bệnh nhân không đáp ứng tiên phát tuân thủ điều trị, phân tích HBV polymerase về các đột biến kháng NA có thể giúp xác định chiến lược điều trị thay thế (xem Bảng 1).
*Đáp ứng virus một phần
Đáp ứng virus một phần được quan sát thấy với tất cả các NA được sử dụng để điều trị viêm gan B mạn tính. Một lần nữa, điều quan trọng là kiểm tra việc tuân thủ điều trị. Có 2 chiến lược điều trị cho bệnh nhân có đáp ứng virus một phần với LMV, ADV hoặc LdT: thay đổi qua một thuốc mạnh hơn (ETV hoặc TFV) càng sớm càng tốt (tuần thứ 24) hoặc thêm vào một thuốc mạnh hơn mà không có chung dữ liệu đề kháng chéo. Như đã được bàn luận và dựa trên dữ liệu in vitro, đơn trị liệu bằng TFV không nên thay thế liệu pháp ADV nếu bệnh nhân nhiễm một biến thể HBV đã kháng với ADV (ví dụ: rtA181T/V± rtN236T) vì các thuốc này thuộc cùng một nhóm hóa học với NA, acyclic phosphonate . Tuy nhiên, cần nhiều dữ liệu hơn để làm rõ hoàn toàn tình huống này (xem bàn luận bên dưới).
Trong trường hợp đáp ứng một phần với TFV hoặc ETV, chuyển đổi sang thuốc khác hoặc tốt nhất là thêm thuốc khác đã được khuyến cáo để đạt được mức DNA HBV không phát hiện được. Tuy nhiên, các chiến lược này chưa được thẩm định đầy đủ bởi các nghiên cứu lâm sàng đa trung tâm lớn.
5.Virus huyết nồng độ thấp dai dẳng và các đợt tăng nhẹ tải lượng virus
Tính dai dẳng của virus huyết nồng độ rất thấp đang trở thành một vấn đề nổi bật lên ở bệnh nhân được điều trị bằng các thuốc có rào cản cao đối với sự đề kháng (ETV, TFV). Thật vậy, độ nhạy của sự phát hiện DNA HBV bằng thử nghiệm PCR ở thời gian thực ngày nay đã đạt được mức 10-15 IU/ml trong khi nó vào khoảng 60-80 IU/ml với các thử nghiệm PCR cũ hơn khi các thuốc này được đánh giá ban đầu trong các thử nghiệm lâm sàng pha III. Trong các nghiên cứu phân tích khi đang điều trị, có đến 5% bệnh nhân chưa từng sử dụng NA có DNA HBV dương tính trong thời gian dài trong thời gian dùng liệu pháp ETV hoặc TFV . Thông thường, các nồng độ virus huyết rất thấp này không cho phép phân tích trình tự genome của virus bằng phân tích quần thể, lai đặc hiệu hoặc phân tích clone. Ý nghĩa lâm sàng và sinh học của hiện tượng này vẫn còn chưa rõ, đặc biệt về mặt xuất hiện kháng thuốc. Tuy nhiên, các nghiên cứu in vitro tiến hành trên nuôi cấy tế bào gan nguyên thủy ở người cũng như các nghiên cứu in vivo trên mô hình HBV vịt đã cho các dữ liệu gợi ý rằng tính dai dẳng của virus huyết trong trị liệu kháng virus có thể dẫn đến nhiễm virus ở các tế bào mới và hình thành các phân tử cccADN mới trong những tế bào này, do đó làm chậm sự loại bỏ các tế bào bị nhiễm virus ra khỏi gan .
Như trong các trường hợp bệnh nhân nhiễm HIV-1 đang dùng liệu pháp kháng virus sao chép ngược hoạt tính cao, một số bệnh nhân đạt được tải lượng virus HBV không phát hiện được có thể gặp phải các đợt virus huyết phát hiện được hoặc tăng nhẹ thoáng qua. Điều này có thể được hiểu như là gợi ý đến sự ức chế sao chép virus không hoàn toàn và/hoặc khởi phát sự đề kháng. Tuy nhiên, dựa trên kinh nghiệm về HIV, điều này không chắc xảy ra vì các đợt tăng nhẹ đã được chứng minh là đại diện cho sự biến thiên về sinh học và thống kê ngẫu nhiên quanh tải lượng virus trung bình dưới giới hạn phát hiện của thử nghiệm . Các đợt tăng nhẹ thoáng qua không liên quan đến phát triển đột biến đề kháng hoặc liên quan đến thất bại về mặt virus học hoặc lâm sàng, đặc biệt trên bệnh nhân dùng liệu pháp phối hợp mà có rào cản cao đối với sự đề kháng.
6.Trường hợp bệnh nhân được trị liệu với nhiều chế độ điều trị kháng virus
Nhiều bệnh nhân hiện nay được điều trị với nhiều thuốc kháng virus, ví dụ bao gồm LMV, ADV, điều trị theo trình tự bằng LMV và ADV, và thậm chí chuyển sang ETV, đặt ra câu hỏi về lựa chọn thuốc cho liệu pháp hàng thứ hai hoặc hàng thứ ba. Ngoài ra, tác dụng kháng virus đạt được với các liệu pháp cấp cứu như trên có thể hứa hẹn tốt qua một lịch sử điều trị đáng kể trước đây.
Trong một nghiên cứu hồi cứu, đa trung tâm tại châu Âu, hiệu quả lâu dài của đơn trị liệu bằng TFV được đánh giá trên bệnh nhân đã thất bại hoặc đề kháng trước đó với các điều trị NA khác nhau. Điều trị trước bao gồm đơn trị liệu bằng LMV, ADV và điều trị theo trình tự bằng LMV-ADV, hoặc liệu pháp phối hợp bổ trợ với cả 2 thuốc. Tỷ lệ tích lũy toàn bộ của các bệnh nhân đạt được nồng độ DNA HBV < 400 copies (bản sao)/ml (< 60 IU/ml) là 79% sau một thời gian điều trị trung bình 23 tháng. Mặc dù sự đề kháng LMV không ảnh hưởng đến hiệu quả kháng virus của TFV, sự hiện diện của đề kháng ADV làm giảm hiệu quả của TFV. Tuy nhiên, không quan sát thấy bùng phát virus ở bất kỳ bệnh nhân nào trong toàn bộ thời gian quan sát .
Điều quan trọng cần lưu ý là các kết quả khác nhau đã đạt được trong một thử nghiệm lâm sàng so sánh các điều trị khác nhau đối với bệnh nhân viêm gan B mạn tính có đáp ứng không hoàn toàn với ADV. Sự kết hợp FTC và TFV với liều cố định từ lúc bắt đầu (kết hợp sớm) so với đơn trị liệu TFV đã được đánh giá. Đến tuần thứ 24 (so sánh trực tiếp liệu pháp mù), đường cong thời gian tắt dần virus giống nhau giữa các nhóm. Tại tuần thứ 48, 81% bệnh nhân đã dùng TFV+FTC (Truvada) ban đầu có mức DNA HBV không phát hiện được. Sự hiện diện đột biến liên quan đến nồng độ LMV hoặc ADV ban đầu không ảnh hưởng đến đáp ứng virus học. Sự tuân thủ điều trị dường như là yếu tố chính liên quan với việc đạt được nồng độ DNA HBV không phát hiện được tại tuần thứ 48 . Ngược lại, một nghiên cứu ở Úc gần đây phân tích hiệu quả của TFV chủ yếu trên bệnh nhân châu Á bị viêm gan B mạn tính đã thất bại với LMV và có sự sao chép virus đáng kể mặc dù đã được điều trị ít nhất 24 tuần với ADV. Tại tuần thứ 48, 46% bệnh nhân đạt được nồng độ DNA HBV không phát hiện được và tại tuần thứ 96, 64% bệnh nhân đạt được nồng độ DNA HBV không phát hiện được. Đáp ứng này không phụ thuộc vào liệu pháp LMV cơ bản hoặc đột biến gây ra đề kháng ADV. Tuy nhiên, xem xét lại đồ thị của từng bệnh nhân riêng biệt, sự hiện diện của đột biến thay thế kháng ADV (rtA181T so với rtN236T ± rtA181T/V) tại thời điểm ban đầu đã có ảnh hưởng đến đáp ứng virus sau đó đối với chuyển đổi sang TFV, khi so sánh với bệnh nhân chưa được điều trị , với nồng độ virus huyết vẫn dai dẳng đáng kể, đặc biệt nếu có đột biến kép rtA181T/V+ rtN236T tại thời điểm ban đầu (Bảng 1).
Kinh nghiệm lâm sàng về sự kết hợp TFV+FTC (Truvada) để điều trị tăng cường ở những bệnh nhân thất bại với các dạng khác nhau của liệu pháp NA như đã cho thấy bởi virus huyết dai dẳng phát hiện được, đã tìm thấy một cách nhất quán về hiệu quả kháng virus rất tốt. Phân tích Kaplan-Meier đã chỉ ra rằng sau điều trị tăng cường bằng sự kết hợp, xác suất HBV-DNA không phát hiện được là 76% vào tuần thứ 48, và đạt được 94% không phát hiện được vào tuần thứ 96. Không xảy ra bùng phát virus . Điều quan trọng là sự kết hợp TFV+LMV không cho thấy lợi ích cao hơn TFV đơn độc trong hầu hết các nghiên cứu .
Kinh nghiệm về ETV trong thực hành lâm sàng ở châu Âu đã chứng minh rằng ETV có hiệu quả trong việc đạt được sự ức chế virus ở bệnh nhân chưa điều trị cũng bằng ở bệnh nhân dùng LMV hoặc ADV, miễn là không phát triển sự đề kháng LMV (rtM204V/I có thể phát hiện được); không đáng ngạc nhiên khi sự hiện diện đề kháng ADV không ảnh hưởng bất lợi lên hiệu quả của ETV trong nghiên cứu đoàn hệ này [90]. Điều đáng chú ý là sự kết hợp ETV+TFV đã từng được sử dụng thành công như một liệu pháp cấp cứu ở những bệnh nhân thất bại với nhiều dạng điều trị .
Những kết quả này cho thấy rằng tùy thuộc vào lịch sử điều trị, sự tiếp xúc với một số nhóm NA khác nhau và sự hiện diện của các đột biến đề kháng vào thời điểm thay đổi điều trị, có thể áp dụng các chiến lược kháng virus khác nhau vì hiệu quả của sự chuyển đổi đơn giản sang một thuốc mới hoặc cộng thêm 2 NA mới (TFV hoặc ETV) có thể cần thiết để đạt được nồng độ HBV DNA không phát hiện được.
VIII.Kết luận
Các nghiên cứu lâm sàng đã chứng minh rằng những thuốc có rào cản cao đối với sự đề kháng như ETV và TFV có tỷ lệ đề kháng thấp hơn đáng kể khi so sánh với những thuốc có rào cản thấp đối với sự đề kháng như LMV, ADV hoặc LdT. Sự lưa chọn đúng liệu pháp điều trị đầu tay nên bao gồm một thuốc có rào cản di truyền cao, hiệu lực mạnh để đạt được sự ức chế sao chép virus duy trì dài hạn, nhờ đó dẫn đến cơ hội tốt nhất để đạt được mục tiêu điều trị chính: phòng ngừa sự tiến triển của bệnh gan. Đa số bệnh nhân nhận được điều trị kháng virus sẽ cần điều trị dài hạn và vì vậy phát triển sự đề kháng chống virus là một mối quan tâm lớn, đặc biệt nếu sử dụng các thuốc có rào cản di truyền thấp, hiệu lực thấp. Điều trị bằng một thuốc mạnh có rào cản cao đối với sự đề kháng như ETV hoặc TFV sẽ làm giảm thiểu cơ hội phát triển đề kháng trong tương lai, bảo tồn các lựa chọn điều trị tương lai và tối đa hóa các cơ hội thành công trong điều trị dài hạn. Việc quản lý sự thất bại điều trị đòi hỏi theo dõi chính xác về lâm sàng và về mặt virus học cũng như can thiệp điều trị sớm bằng các thuốc bổ sung thích hợp đối với dữ liệu về tính đề kháng chéo của chúng (Bảng 1). Với điều kiện là các khuyến cáo này có thể được tuân thủ, đa số bệnh nhân cần điều trị kháng virus để điều trị viêm gan B mạn tính có thể có lợi từ việc điều trị ít nhất là trong ngắn hạn và trung hạn. Theo dõi dài hạn về hiệu quả điều trị và sự xuất hiện kháng thuốc có thể có là cần thiết đối với những bệnh nhân đã được điều trị theo trình tự bằng nhiều thuốc kháng virus. Cuối cùng, việc xác định đích điều trị mới vẫn còn là một thách thức nghiên cứu chính để cải thiện hiệu quả của liệu pháp kháng virus hiện nay và đạt được sự mất HBsAg và ngay cả tiệt trừ HBV là tiêu chí điều trị mong muốn nhất tiếp theo.
| Các điểm chính |
|