 |
|
Hướng dẫn thực hành lâm sàng của Hiệp hội nghiên cứu bệnh gan Châu Âu (EASL): Quản lý nhiễm virus viêm gan C
1. Mở đầu
Nhiễm virus viêm gan C (HCV) là một trong những nguyên nhân chính gây bệnh gan mạn tính trên khắp thế giới . Tác động lâu dài đến gan của sự nhiễm HCV biến thiên lớn, từ những thay đổi nhỏ về gan đến viêm gan mạn tính, xơ hóa mở rộng và xơ gan có hoặc không có ung thư biểu mô tế bào gan (HCC). Số trường hợp bị nhiễm virus mạn tính khắp thế giới có thể vượt quá 200 triệu người, nhưng hầu hết bệnh nhân không có kiến thức về sự nhiễm virus của mình hoặc về tình trạng của gan sau đó. Điều trị lâm sàng đối với bệnh nhân bị bệnh gan liên quan đến HCV đã có những tiến bộ đáng kể trong hai thập kỷ qua, kết quả là nâng cao hiểu biết về cơ chế của bệnh, sự phát triển đáng kể về quy trình chẩn đoán và những tiến bộ trong cách tiếp cận điều trị và phòng ngừa. Tuy nhiên, nhiều phương diện khác nhau vẫn chưa được giải quyết hoàn toàn.
Các hướng dẫn thực hành lâm sàng (CPG) này của EASL nhằm giúp cho các bác sĩ và những nhà cung cấp dịch vụ chăm sóc sức khỏe khác cũng như các bệnh nhân và những người quan tâm trong quá trình ra quyết định trên lâm sàng bằng cách mô tả việc quản lý tối ưu các bệnh nhân nhiễm HCV cấp và mạn tính. Những hướng dẫn này áp dụng đối với các liệu pháp đã được chấp thuận vào thời điểm chúng được công bố. Một số lựa chọn điều trị mới đã hoàn tất việc phát triển phase III đối với những bệnh nhân bị nhiễm HCV genotype 1 và hiện đang chờ đợi sự cấp phép và chấp thuận ở châu Âu và Mỹ. Vì vậy, những hướng dẫn thực hành lâm sàng của EASL về việc quản lý bệnh nhân nhiễm HCV sẽ được cập nhật thường xuyên dựa trên sự chấp thuận các liệu pháp mới bổ sung.
2. Bối cảnh
2.1. Dịch tễ học và gánh nặng y tế công cộng
Ước tính khoảng 130 – 210 triệu người, nghĩa là 3% dân số thế giới bị nhiễm HCV mạn tính . Tỷ lệ hiện mắc thay đổi rõ rệt từ vùng địa lý này đến vùng địa lý khác và trong phạm vi nhóm dân số được đánh giá. Ở Tây Âu, tỷ lệ hiện mắc HCV trong khoảng 0,4% - 3%. Tỷ lệ hiện mắc HCV cao hơn ở Đông Âu và Trung Đông là những vùng có số lượng chưa được biết chính xác . Ai Cập có tỷ lệ hiện mắc cao nhất thế giới, với 9% ở nông thôn và đến 50% ở một số vùng nông thôn do cơ chế nhiễm virus đặc hiệu]. Trước thập niên 1990, những đường lây nhiễm HCV chính là qua truyền máu, quy trình tiêm không an toàn và sử dụng thuốc đường tĩnh mạch. Các cách thức lây nhiễm được ước đoán này giải thích cho khoảng 70% trường hợp ở các nước công nghiêp. Việc sàng lọc các sản phẩm máu tìm HCV bằng thử nghiệm miễn dịch enzyme và ở một số nước châu Âu bằng thử nghiệm acid nucleic đã hầu như tiệt trừ viêm gan C lây nhiễm qua truyền máu. Hiện nay, các trường hợp nhiễm HCV mới chủ yếu là do việc sử dụng thuốc qua đường tĩnh mạch hoặc đường mũi, và ở một mức độ thấp hơn là do các thủ thuật y khoa hoặc thủ thuật ngoại khoa không an toàn. Lây nhiễm qua đường tiêm qua xăm mình hoặc châm cứu với vật liệu không an toàn cũng có liên quan trong một số trường hợp. Nguy cơ của việc lây truyền từ mẹ sang con và qua quan hệ tình dục khác giới thấp trong khi những dữ liệu gần đây cho thấy là sinh hoạt tình dục đồng giới nam bừa bãi có liên quan với nhiễm HCV .
Sáu genotype HCV được đánh số từ 1 đến 6 và một số lớn các type phụ đã được mô tả . Chúng có nguồn gốc từ các vùng khác nhau ở châu Phi và châu Á và một số đã lan rộng khắp thế giới. Genotype 1 (type phụ 1a và 1b) là genotype phổ biến nhất trên khắp thế giới cho đến nay, với sự phổ biến cao hơn về type phụ 1b ở châu Âu và type phụ 1a ở Mỹ. Genotype 3a phổ biến trên những người sử dụng thuốc đường tĩnh mạch ở châu Âu . Hiện nay, nhóm này đang có sự tăng tỷ lệ mới mắc và tỷ lệ hiện mắc HCV liên quan đến genotype 4. Genotype 2 được tìm thấy trong các cụm ở vùng Địa Trung Hải, trong khi genotype 5 và 6 hiếm khi được tìm thấy hơn .
2.2. Tiền sử tự nhiên
Nhiễm HCV cấp tính không có triệu chứng chiếm từ 50 – 90% trường hợp. Việc không tiệt trừ được nhiễm virus một cách tự nhiên xảy ra ở 50 – 90% theo đường lây truyền, sự hiện diện của viêm gan có triệu chứng và theo độ tuổi bị nhiễm virus . Ở châu Âu, nhiễm HCV chịu trách nhiệm đối với khoảng 10% số trường hợp viêm gan cấp tính . Tỷ lệ nhiễm HCV mới cấp tính đã giảm xuống và hiện nay còn khoảng 1/100.000 người/năm, nhưng con số này có lẽ chưa được đánh giá đúng mức vì nó có thể không bao gồm các trường hợp nhiễm virus không có triệu chứng. Nhiễm virus mạn tính liên quan với các mức độ thay đổi của viêm gan và tiến triển xơ hóa, bất kể genotype HCV và tải lượng virus. Chỉ trong trường hợp ngoại lệ sự nhiễm virus qua đi một cách tự nhiên. Sự tiến triển của bệnh gan đã diễn ra qua nhiều thập kỷ và tăng lên do sự hiện diện của các đồng yếu tố như uống rượu, bệnh đái tháo đường (đối với những yếu tố này tự bản thân HCV dường như làm dễ cho sự tiến triển bệnh), tuổi lây nhiễm cao hơn, đồng nhiễm virus gây suy giảm miễn dịch ở người (HIV) hoặc đồng nhiễm các virus hướng gan khác. Tùy thuộc vào sự hiện diện của các đồng yếu tố, khoảng 10% - 40% bệnh nhân bị nhiễm HCV mạn tính sẽ phát triển thành xơ gan [10]. Tử vong liên quan đến các biến chứng của xơ gan có thể xảy ra, với tỷ lệ khoảng 4% mỗi năm, trong khi ung thư biểu mô tế bào gan (HCC) xảy ra ở nhóm dân số này với tỷ lệ mới mắc ước tính từ 1 – 5% mỗi năm . Những bệnh nhân được chẩn đoán bị ung thư biểu mô tế bào gan có xác suất tử vong trong năm đầu tiên là 33% .
Nhiễm HCV đã trở thành nguyên nhân hàng đầu gây ung thư gan nguyên phát ở châu Âu. Dựa trên các mô hình từ Pháp để dự đoán tỷ lệ tử vong do ung thư biểu mô tế bào gan liên quan đến HCV, tỷ lệ tử vong cao nhất liên quan đến nhiễm HCV ở phía trước chúng ta và hiện có các liệu pháp được dự kiến có tác động vừa phải lên tỷ lệ tử vong . Những kết quả này cũng có thể áp dụng cho hầu hết các nước khác ở châu Âu.
Những biểu hiện ngoài gan bao gồm cryoglobulin huyết, liken phẳng, rối loạn chuyển hóa porphyrin biểu hiện da muộn, viêm tuyến nước bọt thâm nhiễm tế bào lympho và viêm cầu thận màng có thể xảy ra. Có một sự kết hợp giữa u lympho không Hodgkin và nhiễm virus viêm gan C .
2.3. Các công cụ hiện có để chẩn đoán, đánh giá độ nặng của bệnh và theo dõi
2.3.1 Công cụ virus học
Chẩn đoán nhiễm HCV mạn tính dựa trên sự hiện diện của cả kháng thể kháng HCV, được phát hiện bằng thử nghiệm miễn dịch enzyme - và HCV RNA, được phát hiện bằng xét nghiệm phân tử. Xét nghiệm HCV DNA cần thiết để quản lý việc điều trị HCV . Các thử nghiệm gần đây nhất dựa trên việc sử dụng phản ứng chuỗi polymerase theo thời gian thực (PCR). Những thử nghiệm này có thể phát hiện các lượng nhỏ HCV RNA (xuống đến 10 đơn vị quốc tế (IU)/ml) và định lượng chính xác nồng độ HCV RNA lên đến khoảng 107 IU/ml. Phạm vi định lượng về động lực học bao gồm đầy đủ các nhu cầu lâm sàng để chẩn đoán và theo dõi . Khi có các thuốc mới như thuốc chống virus tác động trực tiếp, những nồng độ nhạy cảm cao sẽ trở nên có tầm quan trọng chính đối với việc mô tả đặc điểm của đáp ứng virus, các quyết định điều trị và sẽ cần thiết để xác định lại các kết quả HCV DNA ở phạm vi thấp như thế nào được báo cáo.
Genotype và type phụ HCV có thể được xác định qua các phương pháp khác nhau, bao gồm phân tích trình tự trực tiếp, lai ngược, phản ứng chuỗi polymerase theo thời gian thực đặc hiệu genotype . Các thử nghiệm trên sản phẩm thương mại hiện có đã được đưa ra để xác định chính xác 6 genotype HCV. Tuy nhiên, những thử nghiệm nhắm đến vùng 5’ không mã hóa của genome HCV đã không phân biệt được type phụ 1a và 1b của HCV ở một tỷ lệ bệnh nhân đáng kể. Tầm quan trọng của việc xác định đúng type phụ có thể tăng lên một khi có các thuốc mới kháng virus tác động trực tiếp, vì vậy đòi hỏi các phương pháp dựa trên phép lai ngược hoặc trên trình tự chuỗi nhắm đến các đoạn khác hơn là vùng 5’ không mã hóa .
2.3.2. Đánh giá độ nặng của bệnh gan
Đánh giá độ nặng của sự xơ hóa gan là điều quan trọng trong việc đưa ra quyết định về điều trị và tiên lượng bệnh viêm gan C mạn tính. Sinh thiết gan vẫn được xem là phương pháp tham chiếu để đánh giá mức độ viêm và giai đoạn xơ hóa . Những nhược điểm của phương pháp sinh thiết đã được nêu bật trong những năm gần đây và các phương pháp không xâm lấn thay thế đã được phát triển và được đánh giá rộng rãi ở những bệnh nhân bị nhiễm HCV mạn tính. Các phương pháp này bao gồm chỉ điểm huyết thanh và đo độ đàn hồi tạm thời . Hiệu quả của chúng, khi sử dụng đơn độc hoặc kết hợp với nhau đã được báo cáo là tương đương với sinh thiết gan . Cả hai phương pháp không xâm lấn này đã được đưa ra để xác định chính xác bệnh nhân bị xơ hóa hoặc xơ gan nhẹ. Chúng ít có khả năng phân biệt sự xơ hóa trung bình và nặng.
2.3.3. Đặc điểm di truyền của vật chủ
Một số nghiên cứu độc lập liên quan đến toàn bộ genome đã chứng minh rằng các đa hình của vật chủ nằm ở thượng nguồn của gen IL28B (interferon lambda 3) có liên quan với đáp ứng virus kéo dài đối với việc điều trị bằng pegylated interferon alpha kết hợp với ribavirin . Tính đa hình này cũng liên quan với sự làm sạch một cách tự nhiên các trường hợp nhiễm HCV cấp tính, đặc biệt ở những bệnh nhân không có triệu chứng . Sự phân bổ đa hình của IL28B thay đổi giữa các nhóm dân số khắp thế giới và giúp giải thích tính không đồng nhất trong đáp ứng với điều trị dựa trên interferon ở các nhóm chủng tộc hoặc sắc tộc khác nhau . Việc xác định các đa hình của IL28B có thể hữu ích để xác định khả năng đáp ứng của bệnh nhân đối với việc điều trị bằng pegylated interferon alpha và ribavirin; tuy nhiên, giá trị dự đoán thấp. Các biến thể di truyền khác cũng có thể có sự tương quan nào đó với sự tiến triển của bệnh về đáp ứng với điều trị.
2.4. Điều trị chuẩn và các liệu pháp đang phát triển hiện nay
Mục tiêu chính của việc điều trị HCV là chữa trị nhiễm virus, dẫn đến loại trừ HCV trong tuần hoàn có thể phát hiện được sau khi ngừng điều trị. Đáp ứng virus kéo dài (SVR) được định nghĩa là nồng độ RNA HCV không phát hiện được (<50 IU/ml) 24 tuần sau khi ngừng điều trị. Đáp ứng virus kéo dài thường liên quan với sự thuyên giảm bệnh gan ở bệnh nhân không bị xơ gan. Những bệnh nhân bị xơ gan vẫn có nguy cơ bị các biến chứng đe dọa tính mạng; đặc biệt ung thư biểu mô tế bào gan (HCC) có thể xảy ra ngay cả sau khi đã tiệt trừ nhiễm virus. Sự kết hợp pegylated interferon (IFN)-α và ribavirin là phương pháp điều trị chuẩn (SoC) đã được phê duyệt và được chấp nhận rộng rãi đối với bệnh viêm gan C mạn tính . Ở bệnh nhân nhiễm HCV genotype 1, tỷ lệ đáp ứng virus kéo dài sau điều trị chuẩn theo thứ tự là 40% ở Bắc Mỹ và 50% ở Tây Âu trong hầu hết thử nghiệm. Tỷ lệ đáp ứng virus kéo dài cao hơn đáng kể ở những bệnh nhân bị nhiễm HCV genotype 2, 3, 5 và 6 (theo thứ tự là 80% và cao hơn đối với genotype 2 so với các genotype 3, 5 và 6). Các kết quả của việc điều trị đối với những bệnh nhân bị nhiễm genotype 4 xấp xỉ kết quả đối với những bệnh nhân bị nhiễm genotype 1 hoặc tốt hơn một chút ở những bệnh nhân bị nhiễm HCV genotype 4 .
Hai phân tử pegylated IFN-α có thể được sử dụng kết hợp với ribavirin, nghĩa là pegylated IFN-α2a và pegylated IFN-α2b. Dược động học của những hợp chất này khác nhau. Một thử nghiệm ở Mỹ với quy mô lớn sau khi được chấp thuận so sánh các lịch trình khác nhau về việc sử dụng pegylated IFN-α2a và pegylated IFN-α2b với ribavirin ở những bệnh nhân bị nhiễm HCV genotype 1 đã cho thấy không có sự khác biệt đáng kể giữa các chiến lược được thử nghiệm. Ngược lại, hai thử nghiệm ở Ý với các bệnh nhân nhiễm HCV genotype 1, 2, 3 và 4 đã cho thấy một chút lợi ích, hầu hết ở bệnh nhân có genotype 1, thiên về pegylated IFN-α2a kết hợp với ribavirin . Mặc dù hiệu quả vẫn còn được tranh luận, hiện nay không có bằng chứng quyết định là loại pegylated IFN-α được ưa thích hơn một loại khác dưới dạng trị liệu đầu tay.
Một số lớn các loại thuốc điều trị HCV đang ở trong các giai đoạn khác nhau của sự phát triển tiền lâm sàng và lâm sàng . Các chiến lược điều trị mới hướng đến hiệu quả cao hơn, thời gian điều trị ngắn hơn, sử dụng dễ hơn, cải thiện khả năng dung nạp và sự tuân thủ của bệnh nhân. Các nghiên cứu phase III đã được báo cáo gần đây đối với các chất ức chế protease NS3/4, telaprevir và boceprevir, kết hợp với pegylated IFN-α và ribavirin ở những bệnh nhân bị nhiễm HCV genotype 1 chưa sử dụng thuốc và những bệnh nhân không đáp ứng . Những liệu pháp kết hợp 3 thuốc này có khả năng được chấp thuận bởi Cục quản lý Dược phẩm châu Âu (EMA) và Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vào cuối năm 2011, và thay đổi triệt để các chiến lược điều trị đối với những bệnh nhân bị viêm gan mạn tính do genotype 1 HCV ở các nước tiếp cận với những thuốc này (Xem Phần 4.18). Những loại thuốc chống virus tác động trực tiếp khác ở các giai đoạn phát triển lâm sàng trước đó, bao gồm các thuốc ức chế protease bổ sung, chất tương tự nucleoside/nucleotide, thuốc ức chế RNA polymerase phụ thuộc RNA của HCV không có gốc nucleoside, thuốc ức chế NS5A và thuốc ức chế cyclophilin. Các chế độ điều trị không có interferon (IFN), có hoặc không có ribavirin, hiện nay cũng đang được thử nghiệm.
3. Phương pháp học
Các hướng dẫn thực hành lâm sàng (CPG) này của Hiệp hội nghiên cứu bệnh gan châu Âu (EASL) đã được phát triển bởi Hội đồng chuyên gia hướng dẫn thực hành lâm sàng do Ban Quản trị EASL lựa chọn; các khuyến cáo đã được bình duyệt bởi những chuyên gia phê bình bên ngoài và đã được chấp thuận bởi Ban Quản trị EASL. Các hướng dẫn thực hành lâm sàng đã được thiết lập bằng cách sử dụng dữ liệu thu thâp từ sự tìm kiếm cơ sở dữ liệu PubMed và Cochrane trước tháng 12 năm 2010. Các hướng dẫn thực hành lâm sàng dựa trên chứng cứ càng nhiều càng tốt từ các công bố hiện có và nếu chứng cứ không có sẵn thì dựa trên kinh nghiệm và ý kiến cá nhân của các chuyên gia. Mức độ chứng cứ và các khuyến cáo được trích dẫn khi có thể. Chứng cứ và các khuyến cáo trong những hướng dẫn này đã được phân độ theo hệ thống Phát triển và đánh giá các khuyến cáo (GRADE). Vì vậy mức độ tin cậy của các khuyến cáo phản ánh chất lượng của chứng cứ đã có. Các nguyên tắc của hệ thống GRADE đã được đề ra. Chất lượng của các chứng cứ trong hướng dẫn thực hành lâm sàng đã được phân loại theo một trong ba mức độ: cao (A), trung bình (B) hoặc thấp (C). Hệ thống GRADE đề nghị hai cấp độ khuyến cáo: mạnh (1) hoặc yếu (2) (Bảng 1). Vì vậy hướng dẫn thực hành lâm sàng xem xét chất lượng của chứng cứ: chất lượng của chứng cứ càng cao thì khuyến cáo mạnh càng có nhiều khả năng được đảm bảo; sự biến thiên về giá trị và sự ưa thích càng cao hoặc tính không chắc chắn càng cao thì khuyến cáo yếu hơn càng có nhiều khả năng được đảm bảo.
Bảng 1. Phân độ chứng cứ được sử dụng trong Hướng dẫn thực hành lâm sàng của EASL về việc quản lý bệnh nhân nhiễm HCV (phỏng theo hệ thống GRADE)
Chứng cứ |
Chú thích |
|
Chất lượng cao |
Nghiên cứu thêm rất khó để thay đổi sự tin cậy của chúng tôi trong việc ước tính hiệu quả |
A |
Chất lượng trung bình |
Nghiên cứu thêm có thể có tác động quan trọng đến sự tin cậy của chúng tôi trong việc ước tính hiệu quả và có thể làm thay đổi sự ước tính |
B |
Chất lượng thấp |
Nghiên cứu thêm rất có khả năng tác động quan trọng đến sự tin cậy của chúng tôi trong việc ước tính hiệu quả và có thể làm thay đổi sự ước tính. Bất kỳ thay đổi nào về sự ước tính đều không chắc chắn |
C |
Khuyến cáo |
Chú thích |
|
Mạnh |
Các yếu tố ảnh hưởng đến độ tin cậy của khuyến cáo bao gồm chất lượng của chứng cứ, các kết quả quan trọng đối với bệnh nhân được giả định và chi phí |
1 |
Yếu |
Tính biến thiên về sự ưa thích và giá trị, hoặc tính không chắc chắn nhiều hơn. Khuyến cáo được đưa ra với độ chắc chắn ít hơn, chi phí hoặc tiêu thụ nguồn lực cao hơn |
2 |
Hội đồng hướng dẫn thực hành lâm sàng về việc quản lý bệnh nhân nhiễm HCV đã xem xét các câu hỏi dưới đây:
- Bệnh viêm gan C cấp và mạn tính nên được chẩn đoán như thế nào?
- Mục tiêu và tiêu chí của việc điều trị là gì?
- Kết quả của các liệu pháp hiện nay và yếu tố dự đoán đáp ứng là gì?
- Bệnh nhân nên được đánh giá trước điều trị như thế nào?
- Chống chỉ định đối với điều trị là gì?
- Ai nên được điều trị?
- Điều trị đầu tay nào nên được kê đơn?
- Nên quản lý việc điều trị như thế nào?
- Việc điều trị nên thay đổi như thế nào đối với đáp ứng virus?
- Tỷ lệ thành công của điều trị chuẩn (SoC) có thể được cải thiện như thế nào?
- Các bệnh nhân có đáp ứng virus kéo dài (SVR) nên được theo dõi như thế nào?
- Điều gì nên được đề nghị cho các bệnh nhân không có đáp ứng kéo dài đối với điều trị chuẩn?
- Bệnh nhân mắc bệnh gan nặng nên được điều trị như thế nào?
- Các nhóm bệnh nhân đặc biệt nên được điều trị như thế nào?
- Chúng ta nên điều trị bệnh nhân bị viêm gan C cấp tính như thế nào?
- Những bệnh nhân chưa được điều trị và những người không có đáp ứng kéo dài nên được
theo dõi như thế nào?
- Triển vọng của các phương pháp điều trị mới là gì?
4. Hướng dẫn
4.1. Chẩn đoán viêm gan C cấp tính và mạn tính
Chẩn đoán nhiễm HCV dựa trên sự phát hiện kháng thể kháng HCV bằng thử nghiệm miễn dịch enzyme và phát hiện RNA HCV bằng phương pháp phân tử nhạy (giới hạn phát hiện dưới < 50 IU/ml), lý tưởng là thử nghiệm phản ứng chuỗi polymerase (PCR) theo thời gian thực.
Chẩn đoán viêm gan C mạn tính dựa trên sự phát hiện việc nhiễm HCV (có kháng thể kháng HCV và RNA HCV dương tính) ở bệnh nhân có các dấu hiệu viêm gan mạn tính. Trong trường hợp hiếm gặp, ở những bệnh nhân bị ức chế miễn dịch hoàn toàn, kháng thể kháng HCV không phát hiện được và RNA HCV hiện diện đơn độc.
Khuyến cáo
(1) Hỏi tiền sử chi tiết và khám thực thể là điều cần thiết (A2) và nên hỏi bệnh nhân về việc uống rượu (A1).
(2) Chẩn đoán nhiễm HCV dựa trên sự phát hiện kháng thể kháng HCV bằng phương pháp thử nghiệm miễn dịch enzyme (EIA) và phát hiện RNA HCV bằng phương pháp phân tử nhạy (A1).
(3) Để chẩn đoán viêm gan C cấp tính, cần xét nghiệm HCV RNA vì HCV RNA xuất hiện trước khi kháng thể kháng HCV có thể được phát hiện (A2).
(4) Những bệnh nhân bị viêm gan cấp tính có kháng thể kháng HCV dương tính, HCV RNA âm tính nên được xét nghiệm lại sau vài tuần (B2).
(5) Kháng thể kháng HCV và HCV RNA dương tính không phân biệt được viêm gan C cấp tính với đợt cấp của viêm gan C mạn tính hoặc với viêm gan cấp tính do những nguyên nhân khác ở bệnh nhân bị viêm gan C mạn tính (B2).
(6) Viêm gan C mạn tính nên được chứng minh bởi sự hiện diện của cả kháng thể kháng HCV và HCV RNA (A1).
(7) Những bệnh nhân bị ức chế miễn dịch có thể cần một xét nghiệm về HCV RNA nếu có viêm gan nhưng kháng thể kháng HCV không phát hiện được (B2).
4.1.1. Phòng ngừa lây truyền HCV và tiêm chủng chống lại nhiễm HAV và HBV
Hiện nay không có vaccine để phòng ngừa nhiễm HCV . Vì vậy, chỉ có thể tránh lây truyền HCV bằng cách giáo dục và tuân thủ nghiêm ngặt các tiêu chuẩn vệ sinh. Nguy cơ lây truyền HCV thường liên quan đến nồng độ của tải lượng virus HCV. Các yếu tố di truyền cũng có thể góp phần vào tính nhạy cảm đối với sự nhiễm HCV.
Chuyển đổi huyết thanh đối với kháng thể kháng HCV xảy ra dưới 1% trường hợp phơi nhiễm HCV do nghề nghiệp . Ngoài ra, điều trị nội khoa vẫn mang một yếu tố nguy cơ về lây truyền HCV ngay cả ở các nước phương Tây . Bội nhiễm HBV và HAV cấp tính có thể mang lại một diễn tiến nặng hơn ở những bệnh nhân viêm gan C mạn tính mặc dù các dữ liệu mâu thuẫn đã được công bố . Nguy cơ lây nhiễm HCV do quan hệ tình dục rất thấp mặc dù các dữ liệu gần đây cho thấy rằng quan hệ tình dục đồng giới nam bừa bãi liên quan đến nhiễm HCV . Tỷ lệ lây truyền HCV trực tiếp thấp (1-6%). Tỷ lệ lây truyền có thể cao hơn đối với con gái so với con trai và ở các trường hợp người mẹ có HIV dương tính với tải lượng virus HCV cao.
Khuyến cáo
(1) Những người bị thương do kim tiêm nhiễm HCV nên được kiểm tra tìm HCV RNA trong vòng 4 tuần. Cần thực hiện xét nghiệm tìm kháng thể kháng HCV và ALT sau 12 tuần và 24 tuần (B2).
(2) Những người bị nhiễm HCV không nên dùng chung các vật dụng có nguy cơ nhiễm máu như dao cạo râu, kéo, bàn chải đánh răng hoặc kim tiêm với bất kỳ người nào khác (A1).
(3) Các chuyên gia y tế nên được xét nghiệm tìm kháng thể kháng HCV. Các chuyên gia y tế có HCV RNA dương tính cần tránh các hoạt động làm tăng nguy cơ vô ý bị đâm phải hay đứt da hoặc niêm mạc (C2).
(4) Các thành viên trong gia đình của bệnh nhân bị nhiễm HCV nên được xét nghiệm tìm kháng thể kháng HCV ít nhất 1 lần [C1].
(5) Sử dụng bao cao su trong quá trình giao hợp được khuyến cáo chỉ đối với các cá nhân có quan hệ tình dục bừa bãi và tình dục đồng giới nam [A1].
(6) Những người sử dụng ma túy cần được giáo dục về các cách thức lây truyền HCV. Họ nên được xét nghiệm tìm kháng thể kháng HCV thường xuyên. Nên cung cấp kim tiêm vô khuẩn (B2).
(7) Mổ lấy thai không được khuyến cáo đối với phụ nữ có thai bị nhiễm HCV để phòng ngừa lây truyền HCV trực tiếp. Trẻ em có mẹ bị nhiễm HCV nên được xét nghiệm tìm HCV RNA 1 tháng sau khi sinh vì kháng thể kháng HCV truyền thụ động từ mẹ có thể tồn tại trong máu của trẻ vài tháng sau khi sinh. Người mẹ bị viêm gan C mạn tính được phép nuôi con bằng sữa mẹ chừng nào người mẹ vẫn âm tính với HIV và không sử dụng các loại thuốc đường tĩnh mạch (B2).
(8) Bệnh nhân bị viêm gan C mạn tính nên được tiêm chủng chống lại HAV và HBV (B2).
4.2. Mục tiêu và tiêu chí của điều trị HCV
Mục tiêu của việc điều trị là tiệt trừ nhiễm HCV để phòng ngừa các biến chứng của bệnh gan liên quan đến HCV, bao gồm viêm hoại tử, xơ hóa, xơ gan, ung thư biểu mô tế bào gan (HCC) và tử vong.
Tiêu chí của việc điều trị là đáp ứng virus kéo dài (SVR), các chỉ điểm trung gian đã được sử dụng trong quá trình điều trị chuẩn (SoC) để đánh giá khả năng về đáp ứng virus kéo dài và khoảng thời gian điều trị thích ứng. Chúng bao gồm các số đo nồng độ HCV RNA vào tuần thứ 4, 12 và 24 của sự điều trị, được diễn giải khi so sánh với nồng độ HCV RNA ban đầu. Khi HCV được tiệt trừ, sự viêm hoại tử chấm dứt và tiến trình xơ hóa dừng lại ở những bệnh nhân không bị xơ gan.
Khuyến cáo
(1) Mục tiêu của việc điều trị là tiệt trừ nhiễm HCV (A1).
(2) Tiêu chí của việc điều trị là đáp ứng virus kéo dài (A1). Một khi đạt được, thông thường đáp ứng virus kéo dài được xem tương đương với việc chữa khỏi nhiễm virus ở hơn 99% bệnh nhân (A1).
(3) Các chỉ điểm trung gian nhằm đánh giá khả năng đáp ứng virus kéo dài là các nồng độ HCV RNA vào tuần thứ 4, 12 và 24 của sự điều trị (B2).
4.3. Kết quả của các liệu pháp hiện nay và những yếu tố dự báo về đáp ứng
4.3.1. Những bệnh nhân chưa điều trị
Trong các thử nghiệm lâm sàng then chốt để đăng ký liệu pháp pegylated IFN-α và ribavirin, đáp ứng virus kéo dài đã đạt được ở 46 % và 42% số bệnh nhân bị nhiễm HCV genotype 1 được điều trị bằng pegylated IFN-α2a hoặc pegylated IFN-α2b và ribavirin tương ứng . Tỷ lệ đáp ứng virus kéo dài ở những bệnh nhân này hơi cao hơn ở châu Âu so với ở Mỹ. Những kết quả này đã được xác nhận trong thử nghiệm IDEAL so sánh hai chế độ điều trị đã được chấp thuận ở Mỹ: 41% với pegylated IFN-α2a, 180 µg/tuần cộng ribavirin theo cân nặng, 1 – 1,2 g/ngày so với 40% với pegylated IFN-α2b, 1,5 µg/kg/tuần cộng ribavirin theo cân nặng, 0,8 – 1,4 g/ngày trong 48 tuần (NS) . Ở những bệnh nhân bị nhiễm HCV genotype 2 và 3, đáp ứng virus kéo dài đã đạt được trong các thử nghiệm then chốt ở 76% và 82% trường hợp với pegylated IFN-α2a cộng ribavirin và pegylated IFN-α2b cộng với ribavirin tương ứng. Một phân tích tổng hợp gần đây đã cho thấy tỷ lệ đáp ứng virus kéo dài ở các bệnh nhân bị nhiễm virus genotype 2 cao hơn genotype 3 được điều trị trong 24 tuần (74% so với 69% tương ứng) . Một số nghiên cứu “trong đời sống thực tế” gần đây đã báo cáo tỷ lệ đáp ứng virus kéo dài thấp hơn một chút, đặc biệt đối với nhóm nhiễm virus genotype 3 .
Các yếu tố dự báo mạnh nhất về đáp ứng virus kéo dài là các đa hình về di truyền được xác định gần đây ở vị trí nhiễm sắc thể 19, sát vùng mã hóa đối với IL28B (hoặc IFNλ3), genotype HCV và giai đoạn xơ hóa. Các yếu tố dự báo khác về đáp ứng bao gồm nồng độ HCV RNA ban đầu, liều dùng và thời gian thực hiện liệu pháp, các yếu tố của vật chủ như chỉ số khối cơ thể, tuổi, sự đề kháng insulin, giới tính và các đặc điểm của bệnh gan, bao gồm nồng độ ALT, GGT, giai đoạn xơ hóa hoặc đồng nhiễm virus hướng gan khác hoặc HIV .
Tóm tắt về chứng cứ
(1) Đáp ứng virus kéo dài đã đạt được ở 40-54% bệnh nhân bị nhiễm HCV genotype 1 được điều trị bằng pegylated IFN-α cộng ribavirin ở các liều trong 48 tuần đã được chấp thuận (A1).
(2) Đáp ứng virus kéo dài đã đạt được ở 65-82% bệnh nhân bị nhiễm HCV genotype 2 và 3 được điều trị bằng pegylated IFN-α cộng ribavirin ở các liều trong 24 tuần đã được chấp thuận (A1).
(3) Tỷ lệ đáp ứng virus kéo dài hơi cao hơn ở bệnh nhân bị nhiễm HCV genotype 2 so với
bệnh nhân bị nhiễm HCV genotype 3 (B2).
(4) Các yếu tố dự báo về đáp ứng virus kéo dài mạnh nhất là:
a. Genotype HCV (A1).
b. Các đa hình về di truyền ở vị trí nhiễm sắc thể 19 (IL28B), đặc biệt ở những bệnh nhân có genotype 1 (A1).
c. Giai đoạn xơ hóa gan (A1).
4.3.2. Những người bị tái phát
Những người bị tái phát được định nghĩa là những bệnh nhân đã đạt được đáp ứng vào cuối điều trị (nồng độ HCV RNA không phát hiện được vào cuối điều trị) nhưng sau đó tái phát và đã không đạt được đáp ứng virus kéo dài. Tỷ lệ tái phát sau điều trị bằng pegylated IFN-α và ribavirin từ 15 – 25%, nhưng thay đổi theo thời điểm khi HCV RNA trở nên không phát hiện được trong thời gian điều trị.
Những bệnh nhân tái phát sau khi điều trị bằng các chế độ dựa trên IFN chuẩn đáp ứng với việc tái điều trị bằng pegylated IFN-α và ribavirin ở 32 – 53% trường hợp .
4.3.3. Những người không đáp ứng
Những người không đáp ứng là những bệnh nhân không đạt được giảm 2 log HCV RNA IU/ml sau 12 tuần điều trị hoặc những người chưa bao giờ đạt được nồng độ HCV RNA có thể phát hiện được trong thời gian điều trị tối thiểu 24 tuần. Trong hầu hết các thử nghiệm gần đây, việc tái điều trị các bệnh nhân bị nhiễm HCV genotype 1 là những người trước đó đã không thành công khi dùng liệu pháp pegylated IFN-α và ribavirin trong phạm vi từ 4 – 14%.
4.4. Đánh giá trước điều trị
Mối quan hệ nhân quả giữa nhiễm HCV và bệnh gan phải được thiết lập, độ nặng của bệnh gan phải được đánh giá và các thông số ban đầu của virus và vật chủ hữu ích để điều chỉnh điều trị cần được xác định.
4.4.1. Đánh giá bệnh gan
Việc đánh giá bệnh gan nên bao gồm các chỉ điểm sinh hóa như alanine aminotransferase (ALT) và aspartate aminotransferase (AST), gamma-glutamyl transpeptidase (GGT), phosphatase kiềm, bilirubin, thời gian prothrombin hoặc tỷ số chuẩn hóa quốc tế (INR), albumin, gammaglobulin; công thức máu. Siêu âm bụng cũng phải được thực hiện.
4.4.2. Phát hiện và định lượng HCV RNA
HCV RNA phải được phát hiện để xác nhận vai trò của HCV trong mối quan hệ nhân quả. Khi lập kế hoạch điều trị, phải định lượng HCV RNA ban đầu để sử dụng sau đó như một yếu tố tham chiếu nhằm điều chỉnh thời gian điều trị theo động học của HCV RNA. Việc sử dụng thử nghiệm định lượng bằng phản ứng chuỗi polymerase theo thời gian thực được khuyến cáo mạnh mẽ để phát hiện và định lượng HCV RNA do độ nhạy, tính đặc hiệu, độ chính xác và phạm vi nghiên cứu động lực học rộng. Tổ chức Y tế thế giới (WHO) đã xác định một tiêu chuẩn quốc tế đối với việc bình thường hóa biểu hiện về nồng độ HCV RNA. Nồng độ HCV RNA trong huyết thanh nên được biểu hiện bằng IU/ml để đảm bảo tính so sánh. Các thử nghiệm trên sản phẩm thương mại chuẩn hóa được ưa thích hơn là các kỹ thuật “nội bộ” không được chuẩn hóa, và thử nghiệm tương tự nên được sử dụng ở mỗi bệnh nhân để đảm bảo tính đồng nhất khi đánh giá đáp ứng chống virus.
Khuyến cáo
(1) Việc phát hiện và định lượng HCV RNA nên được thực hiện bằng một thử nghiệm nhạy (giới hạn dưới của mức phát hiện là 50 IU/ml hoặc thấp hơn), lý tưởng là thử nghiệm phản ứng chuỗi polymerase theo thời gian thực và nồng độ HCV RNA nên được biểu hiện bằng IU/ml (C1).
4.4.3. Tìm kiếm các nguyên nhân khác gây bệnh gan
Các nguyên nhân khác gây bệnh gan mạn tính nên được điều tra một cách hệ thống, bao gồm sự đồng nhiễm HIV và/hoặc các virus hướng gan khác. Các bệnh đồng thời, bao gồm nghiện rượu, bệnh tự miễn hoặc bệnh gan do chuyển hóa với thoái hóa mỡ hoặc viêm gan nhiễm mỡ cần được đánh giá. Điều hữu ích là loại trừ bệnh tuyến giáp có từ trước và các kháng thể kháng peroxidase tuyến giáp.
Khuyến cáo
(1) Mối quan hệ nhân quả giữa nhiễm HCV với bệnh gan phải được thiết lập (B1).
4.4.4. Đánh giá độ nặng của bệnh gan
Việc đánh giá độ nặng của bệnh gan được khuyến cáo trước khi điều trị. Xác định các bệnh nhân bị xơ gan có tầm quan trọng đặc biệt, vì khả năng đáp ứng với điều trị và tiên lượng sau điều trị bị thay đổi và cần giám sát ung thư biểu mô tế bào gan. Không cần đánh giá giai đoạn xơ hóa bằng sinh thiết ở những bệnh nhân có chứng cứ xơ gan trên lâm sàng. Vì sự xơ hóa đáng kể có thể hiện diện ở bệnh nhân có nồng độ ALT bình thường lặp lại, việc đánh giá độ nặng của bệnh cần được thực hiện bất kể nồng độ ALT. Nội soi để loại trừ giãn tĩnh mạch thực quản và tăng áp lực tĩnh mạch cửa cần được thực hiện ở những bệnh nhân đã biết bị xơ gan.
Sinh thiết gan vẫn là phương pháp tham chiếu. Nguy cơ bị biến chứng nặng rất thấp (1/4.000 – 10.000) nhưng sinh thiết vẫn là một thủ thuật xâm lấn. Các đặc điểm về mô học (viêm hoại tử: phân hạng; xơ hóa: định giai đoạn) cần được báo cáo bằng cách sử dụng phương pháp cấu trúc, bán định lượng. Nhiều hệ thống thang điểm khác nhau đã được thẩm định để sử dụng trong viêm gan C mạn tính. Hệ thống được sử dụng rộng rãi nhất ở châu Âu là METAVIR, Scheuer, Ishak và Knodell’s HAI . Thang điểm của Metavir và Scheuer có thể nhân rộng hơn và ít bị thay đổi do người quan sát, tuy nhiên ít phân biệt hơn về cả sự xơ hóa và viêm hoại tử so với Ishak and Knodell .
Dựa trên nhiều y văn về viêm gan C mạn tính, hiện nay các phương pháp thay thế không xâm lấn có thể được sử dụng thay cho sinh thiết gan ở những bệnh nhân bị viêm gan C mạn tính để đánh giá độ nặng của bệnh trước khi điều trị ở mức an toàn có thể dự đoán được.
Đo độ đàn hồi tạm thời (TE) có thể được dùng để đánh giá sự xơ hóa gan ở những bệnh nhân bị viêm gan C mạn tính, với điều kiện là xem xét các yếu tố có thể ảnh hưởng bất lợi đến sự thực hiện của phương pháp này như béo phì, tuổi và hoạt động viêm hoại tử về mặt sinh hóa. Kết quả của đo độ đàn hồi tạm thời nên được đánh giá liên quan đến khoảng tứ phân vị và tỷ lệ thành công của phép đo. Đo độ đàn hồi tạm thời thực hiện tốt hơn trong việc phát hiện xơ gan so với phát hiện mức độ xơ hóa ít hơn .
Các bảng chỉ điểm sinh học về xơ hóa được thiết lập rõ ràng có thể được phân loại rộng rãi là những bảng bao gồm các xét nghiệm sinh hóa và huyết học thường được thực hiện như ALT, AST, thời gian prothrombin, tiểu cầu (chỉ số của tỷ số aspartate aminotransferase với tiểu cầu: APRI, tỷ số AST/ALT, chỉ số Forns); những bảng bao gồm các chỉ điểm xơ hóa gan gián tiếp không đặc hiệu như α-2 macroglobulin; những bảng chỉ kết hợp các chỉ điểm xơ hóa gan trực tiếp (MP3) hoặc kết hợp các chỉ điểm trực tiếp và gián tiếp (Hepascore, Fibrometer). Chứng cứ đầy đủ hiện có hỗ trợ cho quan điểm là các thuật toán thực hiện tốt trong việc phát hiện xơ hóa đáng kể (thang điểm METAVIR F2-F4). Vì vậy, việc sử dụng chúng ở bệnh nhân bị viêm gan C mạn tính có thể đươc khuyến cáo cho mục đích này. Tất cả các thuật toán đều thực hiện kém hơn trong việc phát hiện các mức độ xơ hóa ít hơn .
Sự kết hợp các xét nghiệm máu hoặc kết hợp đo độ đàn hồi tạm thời và xét nghiệm máu cải thiện độ chính xác và làm giảm sự cần thiết sử dụng sinh thiết gan để giải quyết trường hợp không chắc chắn. Tuy nhiên chúng làm tăng chi phí .
Khuyến cáo
(1) Cần đánh giá độ nặng của bệnh gan trước điều trị (B1)
(2) Xác định các bệnh nhân bị xơ gan có tầm quan trọng đặc biệt, vì tiên lượng và khả năng đáp ứng với điều trị thay đổi, và cần giám sát ung thư biểu mô tế bào gan (A1).
(3) Vì bệnh gan có thể tiến triển ở bệnh nhân có nồng độ ALT bình thường lặp lại, việc đánh giá độ nặng của bệnh cần được thực hiện bất kể nồng độ ALT (B2).
4.4.5. Đánh giá các đa hình về di truyền của bệnh nhân
Nên đánh giá genotype HCV trước khi bắt đầu điều trị vì nó ảnh hưởng đến quyết định về liều dùng của ribavirin và thời gian điều trị. Với điều trị chuẩn hiện nay, chỉ nên xác định genotype (1-6). Phương pháp tham chiếu là phân tích trình tự trực tiếp vùng 5B không cấu trúc. Nhìn chung, thử nghiệm định genotype của sản phẩm thương mại thế hệ cuối dựa trên phân tích trình tự trực tiếp vùng 5’ không dịch mã hoặc trên sự lai ngược cả vùng 5’ không dịch mã và vùng lõi đều thích hợp để phân biệt các genotype HCV trong thực hành lâm sàng. Sự cần thiết định type phụ có thể tăng lên trong tương lai do các hàng rào về di truyền khác nhau trong sự kháng lại các chất ức chế protease của type phụ HCV 1avà 1b.
Khuyến cáo
(1) Phải đánh giá genotype HCV trước khi điều trị chống virus và sẽ xác định liều ribavirin và quyết định điều trị (A1).
(2) Với điều trị chuẩn, chỉ genotype (1-6), không có type phụ là cần được xác định (A1).
4.4.6. Xác định yếu tố di truyền của vật chủ
Các đa hình của vật chủ nằm ở thượng nguồn của gen IL28B có liên quan đến đáp ứng virus kéo dài đối với điều trị bằng pegylated interferon alpha kết hợp với ribavirin ở bệnh nhân bị nhiễm HCV genotype 1 . Tuy nhiên, giá trị dự đoán trên từng cá thể thấp. Việc xác định các đa hình này có thể hữu ích để đánh giá khả năng đáp ứng của bệnh nhân với điều trị bằng interferon alpha và ribavirin, nhưng không nên sử dụng để trì hoãn điều trị ở những người ít có khả năng đáp ứng nhưng rất cần điều trị, tức là những bệnh nhân có xơ hóa đáng kể. Các đa hình của IL28 ít hữu ích ở những bệnh nhân bị nhiễm HCV genotype 2 và 3 .
Khuyến cáo
(1) Việc xác định các đa hình của IL28B có thể giúp đánh giá khả năng đáp ứng của bệnh nhân với điều trị bằng pegylated interferon alpha và ribavirin (B2).
Việc điều trị viêm gan C mạn tính bằng interferon có các chế độ chống chỉ định tuyệt đối ở những bệnh nhân không có lựa chọn ghép gan ở các nhóm sau đây: trầm cảm chưa được kiểm soát, loạn tâm thần hoặc động kinh; bệnh tự miễn chưa được kiểm soát; (Child-Pugh B7 hoặc lớn hơn); phụ nữ mang thai hoặc những cặp vợ chồng không sẵn sàng tuân thủ phương pháp ngừa thai thích hợp; bệnh nội khoa nặng đồng thời như tăng huyết áp được kiểm soát kém, suy tim, đái tháo đường được kiểm soát kém và bệnh phổi tắc nghẽn mạn tính. Các chống chỉ định tương đối với điều trị là các chỉ số huyết học bất thường (hemoglobin < 13 g/dl đối với nam giới và < 12 g/dl đối với phụ nữ, số lượng bạch cầu trung tính < 1500/mm3, số lượng tiểu cầu < 90.000/mm3); nồng độ creatinine huyết thanh > 1,5 mg/dl; bệnh mạch vành đáng kể và bệnh tuyến giáp chưa được điều trị. Mặc dù những bệnh nhân mất bù thường không nên được điều trị, việc trị liệu những bệnh nhân bị bệnh gan tiến triển (xơ gan Child B) là những người mà các thông số có thể nằm dưới mức khuyến cáo trên nhãn có thể thực hiện được ở những trung tâm có kinh nghiệm dưới sự theo dõi cẩn thận.
Khuyến cáo
(1) Những bệnh nhân có chống chỉ định tuyệt đối với điều trị chuẩn (SoC) không nên được điều trị (A1).
4.6 Chỉ định điều trị: Ai nên được điều trị?
Tất cả các bệnh nhân bị mắc bệnh gan mạn tính còn bù liên quan đến HCV chưa được điều trị, sẵn sàng điều trị và không có chống chỉ định với pegylated IFN-α hoặc ribavirin nên được xem xét để điều trị, dù nồng độ ALT ban đầu như thế nào. Nên khởi đầu điều trị ở bệnh nhân có xơ hóa tiến triển (thang điểm METAVIR F3-F4) và xem xét cẩn thận ở bệnh nhân có xơ hóa trung bình (F2). Ở bệnh nhân bị bệnh gan nhẹ, đặc biệt với nhiễm trùng kéo dài, phải lưu ý sự cân bằng giữa lợi ích và nguy cơ, đồng thời cũng tính đến triển vọng của các thuốc mới và kỳ vọng sống của bệnh nhân.
Bệnh nhân nhiễm HCV genotype 1 không tiệt trừ được HCV sau khi được điều trị trước đó bằng pegylated IFN-α và ribavirin không nên được tái điều trị với cùng một liệu pháp, vì tỷ lệ đáp ứng virus kéo dài (SVR) thấp (theo thứ tự từ 9-15% đối với tất cả các genotype và 4-6% đối với genotype 1) . Những bệnh nhân này nên chờ đợi sự chấp thuận liệu pháp kết hợp mới là phương pháp điều trị cho thấy đạt được tỷ lệ đáp ứng virus kéo dài cao hơn, theo thứ tự từ 30-60%, tùy thuộc vào loại không đáp ứng trước đó và giai đoạn của bệnh gan .
Bệnh nhân bị nhiễm HCV có các genotype khác genotype 1 đã thất bại trong điều trị trước đó bằng IFN-α có hoặc không có ribavirin có thể được tái điều trị bằng pegylated IFN-α và ribavirin, với điều kiện không có khả năng các thuốc mới có hoạt tính kháng lại HCV không phải genotype 1.
Khuyến cáo
(1) Tất cả các bệnh nhân bị mắc bệnh gan do HCV còn bù chưa được điều trị nên được
xem xét điều trị (A2).
(2) Nên khởi đầu điều trị nhanh chóng ở bệnh nhân có xơ hóa tiến triển (thang điểm
METAVIR F3-F4) và xem xét cẩn thận ở bệnh nhân có xơ hóa trung bình (F2) (B2).
(3) Ở bệnh nhân bị bệnh gan ít nặng hơn, chỉ định điều trị theo từng cá nhân (C2).
4.7. Điều trị đầu tay bệnh viêm gan C mạn tính: Khuyến cáo điều trị là gì?
Điều trị đầu tay bệnh viêm gan C mạn tính dựa trên việc sử dụng một trong hai loại pegylated IFN-α hiện có, tiêm dưới da mỗi tuần và ribavirin dùng đường uống mỗi ngày (A1). Pegylated IFN-α2a nên được dùng ở liều 180 µg, 1 lần/tuần, trong khi pegylated IFN-α2b nên được dùng với liều theo cân nặng là 1,5 µg/kg/tuần. Liều ribavirin tùy thuộc vào genotype HCV. Bệnh nhân bị nhiễm HCV genotype 1 và 4-6 nên được dùng liều ribavirin theo cân nặng: 15 mg/kg thể trọng/ngày. Bệnh nhân bị nhiễm HCV genotype 2 hoặc 3 có thể được điều trị một liều cố định 800 mg ribavirin/ngày, nhưng đối với những người có chỉ số khối cơ thể (BMI) > 25 hoặc những người có các yếu tố cơ bản cho thấy đáp ứng thấp (đề kháng insulin, hội chứng chuyển hóa, xơ hóa nặng hoặc xơ gan, cao tuổi) nên nhận liều ribavirin theo cân nặng, tương tự như genotype 1 và 4. Nên áp dụng biện pháp tránh thai nghiêm ngặt trên bệnh nhân được điều trị bằng pegylated IFN-α và ribavirin trong quá trình trị liệu và 6 tháng sau đó. Điều trị bằng pegylated IFN-α và ribavirin thực sự có hiệu quả chi phí ngay cả đối với xơ hóa giai đoạn sớm .
Khuyến cáo
4.8. Theo dõi điều trị
Theo dõi điều trị bao gồm theo dõi hiệu quả điều trị và bất kỳ tác dụng phụ nào.
Khuyến cáo
4.8.1. Theo dõi hiệu quả điều trị
Theo dõi hiệu quả điều trị dựa trên đo lặp lại nồng độ HCV RNA. Nên sử dụng một phương pháp định lượng nhạy, chính xác với phạm vi định lượng về động học rộng, lý tưởng là định lượng dựa trên phản ứng chuỗi polymerase (PCR) theo thời gian thực. Nên sử dụng phương pháp định lượng tương tự, lý tưởng là từ cùng một phòng thí nghiệm trên mỗi bệnh nhân để đo HCV RNA tại các thời điểm khác nhau, nhằm đảm bảo sự đồng nhất kết quả.
Điều trị rút ngắn (24 tuần) được chỉ định đối với bệnh nhân có genotype 1 và nồng độ HCV RNA ban đầu thấp so với nồng độ ban đầu cao và không phát hiện được sau 4 tuần điều trị. Hiện nay chưa có sự đồng thuận về nồng độ HCV RNA khác biệt lớn nhất, trong khoảng từ 400.000 - 800.000 IU/ml (5,6-5,9 log10 IU/ml) .
Để theo dõi hiệu quả điều trị và hướng dẫn ra quyết định về thời gian điều trị, đo nồng độ HCV RNA nên được thực hiện lúc ban đầu, tuần thứ 4, 12, 24, cuối điều trị và 24 tuần sau khi kết thúc điều trị để đánh giá đáp ứng virus kéo dài. Nên đo nồng độ ALT tại cùng thời điểm như nồng độ HCV RNA. Đáp ứng sinh hóa (bình thường hóa ALT) thường xảy ra sau đáp ứng virus học vài tuần.
Khuyến cáo
(1) Định lượng dựa trên phản ứng chuỗi polymerase (PCR) theo thời gian thực, với giới
hạn phát hiện dưới ở 10-20 IU/ml là công cụ tốt nhất để theo dõi việc điều trị (B1).
(2) Nồng độ HCV RNA ban đầu thấp so với nồng độ ban đầu cao hữu ích để hướng dẫn
ra quyết định điều trị (B2). Nồng độ HCV RNA khác biệt lớn nhất trong khoảng từ
400.000 - 800.000 IU/ml (C2).
(3) Trong thời gian điều trị, đo nồng độ HCV RNA nên được thực hiện ở tuần thứ 4, 12
và 24 nhằm giúp điều chỉnh trị liệu (A2).
(4) Đáp ứng virus cuối điều trị và đáp ứng virus kéo dài 24 tuần sau khi kết thúc điều trị
phải được đánh giá (A1).
4.8.2. Theo dõi an toàn trong điều trị
Các triệu chứng giống cúm thường xuất hiện sau khi tiêm pegylated IFN-α. Những triệu chứng này được kiểm soát dễ dàng bằng paracetamol và có xu hướng giảm dần sau 4-6 tuần điều trị.
Tại mỗi lần thăm khám, cần đánh giá bệnh nhân về các tác dụng phụ trên lâm sàng như tình trạng mệt nặng, trầm cảm, dễ bị kích thích, rối loạn giấc ngủ, phản ứng da và khó thở. Các tác dụng phụ về huyết học và sinh hóa của pegylated IFN-α và ribavirin bao gồm giảm bạch cầu trung tính, thiếu máu, giảm tiểu cầu và tăng đột ngột ALT. Những thông số này nên được đánh giá vào tuần thứ 1, 2 và 4 của sự trị liệu và ở khoảng cách 4-8 tuần sau đó. Nên đo nồng độ hormon kích thích tuyến giáp (TSH) và thyroxin tự do mỗi 12 tuần trong khi điều trị . Các tác dụng phụ bất thường hoặc nặng bao gồm co giật, nhiễm khuẩn, phản ứng tự miễn, bệnh phổi kẽ, viêm thần kinh thị-võng mạc, bất sản tủy xương hoặc giảm tiểu cầu tự phát. Bệnh nhân nên được tư vấn về nguy cơ gây quái thai của ribavirin và sự cần thiết dùng biện pháp tránh thai trong và 6 tháng sau khi điều trị.
Khuyến cáo
(1) Nên đánh giá độc tính của việc điều trị ở tuần thứ 2 và 4 của trị liệu và mỗi 4-8 tuần sau đó (C2).
4.9. Các nguyên tắc giảm liều và ngừng điều trị
Nên giảm liều pegylated IFN-α trong trường hợp có các tác dụng phụ nặng như các triệu chứng lâm sàng của trầm cảm nặng, và nếu số lượng tuyệt đối của bạch cầu trung tính giảm dưới 750/mm3, hoặc số lượng tiểu cầu giảm dưới 50.000/mm3. Trong những trường hợp riêng biệt, bác sĩ có thể chọn duy trì hoặc giảm liều trong các tình huống này nhưng cần phải theo dõi thận trọng. Khi sử dụng pegylated IFN-α2a, có thể giảm liều từ 180 xuống 135 µg/tuần và sau đó xuống 90 µg/tuần. Khi sử dụng pegylated IFN-α2b, có thể giảm liều từ 1,5 đến 1 µg/kg/tuần và sau đó xuống 0,5 µg/kg/tuần. Nên ngừng pegylated IFN-α trong trường hợp trầm cảm rõ rệt, nếu số lượng bạch cầu trung tính giảm dưới 500/mm3 hoặc số lượng tiểu cầu giảm dưới 25.000/mm3. Nếu số lượng bạch cầu trung tính hoặc tiểu cầu tăng lên, có thể bắt đầu lại trị liệu, nhưng giảm liều pegylated IFN-α. Nếu thiếu máu đáng kể xảy ra (hemoglobin < 10 g/dl), nên điều chỉnh giảm liều ribavirin 200 mg mỗi lần. Nên ngừng dùng ribavirin nếu nồng độ hemoglobin giảm dưới 8,5 g/dl. Thay vào đó, có thể dùng yếu tố tăng trưởng để duy trì liều cao pegylated IFN-α và/hoặc ribavirin (xem dưới đây).
Có thể ngừng điều trị ngay lập tức trong trường hợp bùng phát viêm gan (nồng độ ALT cao hơn 10 lần mức bình thường, nếu chưa xuất hiện tại thời điểm bắt đầu điều trị) hoặc nếu nhiễm khuẩn nặng xảy ra ở bất kỳ vùng nào của cơ thể, bất kể số lượng bạch cầu trung tính.
Khuyến cáo
(1) Nên giảm liều pegylated IFN-α nếu số lượng số lượng tuyệt đối của bạch cầu trung tính
giảm dưới 750/mm3, hoặc số lượng tiểu cầu giảm dưới 50.000/mm3, và ngừng thuốc
nếu số lượng tuyệt đối của bạch cầu trung tính giảm dưới 500/mm3 hoặc số lượng tiểu
cầu giảm dưới 25.000/mm3 hoặc xuất hiện trầm cảm nặng không thể quản lý được
(C2).
(2) Nếu số lượng bạch cầu trung tính hoặc tiểu cầu tăng lên, có thể bắt đầu lại trị liệu,
nhưng giảm liều pegylated IFN-α (C2).
(3) Nếu thiếu máu đáng kể xảy ra (hemoglobin < 10 g/dl), nên điều chỉnh giảm liều
ribavirin 200 mg mỗi lần (C2) và nên ngừng dùng ribavirin nếu nồng độ hemoglobin
giảm dưới 8,5 g/dl.
(4) Nên ngừng điều trị trong trường hợp bùng phát viêm gan hoặc nhiễm khuẩn nặng (C2).
4.10. Điều trị theo đáp ứng virus
Thời gian điều trị bằng pegylated IFN-α và ribavirin có thể được điều chỉnh theo đáp ứng virus khi đang điều trị. Trong khi điều trị, cần đánh giá HCV RNA tại 3 thời điểm, bất kể genotype HCV: lúc ban đầu, tuần thứ 4 và 12. Xét nghiệm vào tuần thứ 24 có thể hữu ích ở những bệnh nhân được chọn. Khả năng đáp ứng virus kéo dài tỷ lệ trực tiếp với thời gian HCV RNA biến mất (Hình 1).
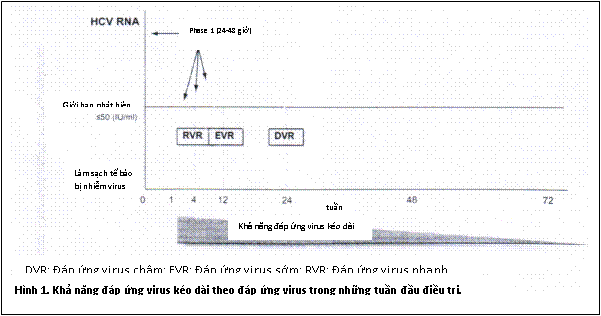
Bảng 2: Theo dõi đáp ứng điều trị đối với PEG IFN-α cộng ribavirin
Đáp ứng virus kéo dài (SVR) |
Nồng độ HCV RNA không phát hiện được (<50 IU/ml), 24 tuần sau điều trị |
Đáp ứng virus nhanh (RVR) |
HCV RNA không phát hiện được trong một phép định lượng nhạy (giới hạn phát hiện dưới ≤ 50 IU/ml), ở tuần thứ 4 của quá trình điều trị, duy trì cho đến cuối điều trị. |
Đáp ứng virus sớm (EVR) |
HCV RNA có thể phát hiện được ở tuần thứ 4 nhưng không phát hiện được ở tuần thứ 12, duy trì cho đến cuối điều trị. |
Đáp ứng virus chậm (DVR) |
Có sự giảm nhiều hơn 2 log10 nhưng HCV RNA có thể phát hiện được ở tuần thứ 12, không phát hiện được HCV RNA ở tuần thứ 24, duy trì đến cuối điều trị. |
Không đáp ứng (NR) |
Nồng độ HCV RNA giảm ít hơn 2 log10 IU/ml so với mức ban đầu ở tuần thứ 12 của quá trình điều trị. |
Không đáp ứng một phần (PR) |
Nồng độ HCV RNA giảm nhiều hơn 2 log10 IU/ml so với mức ban đầu ở tuần thứ 12 của quá trình điều trị nhưng có thể phát hiện được HCV RNA ở tuần thứ 12 và 24. |
Bùng phát virus (BT) |
HCV RNA tái xuất hiện ở bất kỳ thời gian nào trong quá trình điều trị sau khi có đáp ứng virus. |
Việc điều trị nên ngừng lại ở tuần thứ 12 nếu nồng độ HCV RNA giảm ít hơn 2 log10 IU/ml, tức là nếu nồng độ HCV RNA ban đầu giảm ít hơn 99% của giá trị ban đầu, như vậy tỷ lệ đáp ứng virus kéo dài ở những bệnh nhân này với thời gian điều trị chuẩn là ít hơn 2%. Ở những bệnh nhân có HCV RNA có thể phát hiện được (≥ 50 IU/ml) ở tuần thứ 24, cũng nên ngừng điều trị do cơ hội đạt được đáp ứng virus kéo dài rất ít (1-3%) .
Những bệnh nhân giảm nhiều hơn 2 log10 hoặc có HCV RNA không phát hiện được ở tuần thứ 12 có thể được phân loại thành 3 nhóm theo đáp ứng virus của họ (Bảng 2): (1) đáp ứng virus nhanh được định nghĩa là nồng độ HCV RNA có thể phát hiện được trong một phép định lượng nhạy (giới hạn phát hiện dưới ≤ 50 IU/ml) ở tuần thứ 4 của quá trình điều trị (khoảng 24-27% bệnh nhân nhiễm virus genotype 1 và 64-76% bệnh nhân nhiễm virus genotype 2 hoặc 3 có đáp ứng virus nhanh), (2) đáp ứng virus sớm (EVR) được định nghĩa là HCV RNA có thể phát hiện được ở tuần thứ 4 nhưng không phát hiện được ở tuần thứ 12, (3) đáp ứng virus chậm (DVR) được định nghĩa là nồng độ HCV RNA giảm nhiều hơn 2 log10 nhưng nồng độ HCV RNA có thể phát hiện được ở tuần thứ 12 và nồng độ HCV RNA không phát hiện được ở tuần thứ 24 (khoảng 22-31% bệnh nhân nhiễm virus genotype 1 có đáp ứng virus chậm). Đến cuối bất kỳ quá trình điều trị nào, tất cả các loại đáp ứng virus (RVR, EVR, DVR) phải được theo dõi bằng các phương pháp định lượng, đảm bảo là HCV RNA không phát hiện được. Sự tái xuất hiện của HCV RNA ở bất kỳ thời gian nào trong quá trình điều trị sau đáp ứng virus được gọi là sự bùng phát virus (BT).
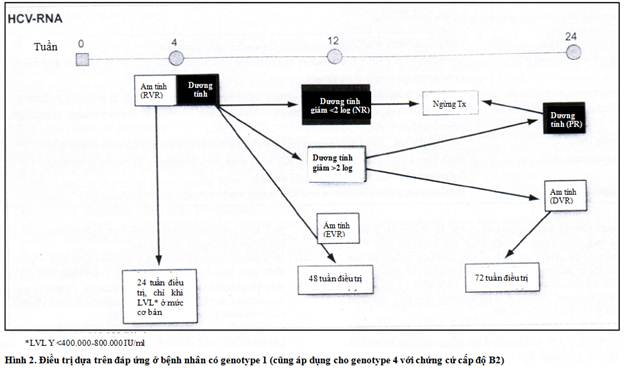
Thời gian điều trị sau đây nên áp dụng theo đáp ứng virus, bất kể genotype của HCV:
(i) Bệnh nhân nhiễm HCV genotype 1 có đáp ứng virus kéo dài nên được điều trị trong 24 tuần nếu họ có nồng độ virus ban đầu thấp, như được cho thấy trong một phân tích tổng hợp gần đây. Vì chưa có sự chắc chắn rằng ngưỡng nào nên dùng để phân biệt giữa nồng độ HCV RNA ban đầu thấp và cao, bệnh nhân bị nhiễm HCV genotype 1 (và cũng có khả năng bị nhiễm virus genotype 4) có nồng độ virus ban đầu dưới 400.000 – 800.000 IU/ml nên được điều trị trong 24 tuần, trong khi hợp lý để điều trị kéo dài đến tổng cộng 48 tuần ở bệnh nhân có nồng độ HCV RNA ban đầu cao hơn.
(ii) Bệnh nhân bị nhiễm HCV genotype 1 (cũng có khả năng nhiễm virus genotype 4) và đáp ứng virus sớm (EVR) nên được điều trị trong 48 tuần .
(iii) Bệnh nhân có genotype 1 và đáp ứng virus chậm (DVR) nên được điều trị trong 72 tuần với hy vọng giảm thiểu nguy cơ tái phát, với điều kiện là HCV RNA không phát hiện được ở tuần thứ 24. Các dữ liệu hiện có không đầy đủ đối với các genotype khác .
(iv) Ở bệnh nhân bị nhiễm HCV genotype 2 và 3 có đáp ứng virus nhanh (RVR) và tải lượng virus ban đầu thấp (< 400.000 – 800.000 IU/ml), có thể xem xét rút ngắn thời gian điều trị xuống còn 16 tuần, có thể dẫn đến cơ hội tái phát sau điều trị hơi cao hơn.
(v) Ở bệnh nhân bị nhiễm HCV genotype 2 và 3 có xơ hóa tiến triển, xơ gan hoặc các đồng yếu tố ảnh hưởng đến đáp ứng (đề kháng insulin, hội chứng chuyển hóa, thoái hóa mỡ không do virus), không nên xem xét rút ngắn thời gian điều trị xuống còn 16 tuần ngay cả nếu họ có nồng độ virus ban đầu thấp và đáp ứng virus nhanh, do không đủ chứng cứ về hiệu quả tương đương .
(vi) Bệnh nhân có genotype 2 và 3, đáp ứng virus sớm (EVR) hoặc đáp ứng virus chậm (DVR) hoặc với các đồng yếu tố bất lợi ảnh hưởng đến đáp ứng có thể được điều trị trong 48 hoặc 72 tuần, tương ứng, với điều kiện là không phát hiện được HCV RNA ở tuần thứ 24 .
(vii) Chưa có dữ liệu về điều trị dựa vào đáp ứng ở bệnh nhân bị nhiễm HCV genotype 5 và 6. Tuy nhiên, các genotype này thường cho thấy tỷ lệ đáp ứng tương tự khi so sánh với bệnh nhân bị nhiễm HCV genotype 3 .
Dữ liệu điều trị dựa vào đáp ứng được nêu ở Hình 2 đối với genotype 1 và Hình 3 đối với genotype 2 và 3.
Khuyến cáo

4.11. Các phương pháp đánh giá để cải thiện tỷ lệ thành công của điều trị
Nên tiến hành các phương pháp đánh giá đơn giản để cải thiện tỷ lệ thành công của điều trị, do chúng cho thấy liên quan đến tỷ lệ đáp ứng virus kéo dài (SVR) cao hơn đáng kể.
4.11.1. Tuân thủ điều trị
Tuân thủ hoàn toàn việc điều trị bằng pegylated IFN-α và ribavirin liên quan với tỷ lệ đáp ứng virus kéo dài được cải thiện . Người ta khuyến cáo rằng bất kỳ sự giảm liều nào phải được xem xét và tái thiết lập một liều đầy đủ càng sớm càng tốt để đạt được và duy trì sự tiếp xúc tối đa với mỗi thuốc . Các yếu tố ảnh hưởng sự tuân thủ điều trị đã được xem xét và giải quyết trong các nghiên cứu riêng biệt. Những nghiên cứu này đã cho thấy là tình trạng vô gia cư, sử dụng hoạt chất ma túy dạng tiêm hoặc đang điều trị thay thế bằng chế phẩm có thuốc phiện có thể được giải quyết để dẫn đến tỷ lệ đáp ứng virus kéo dài tương đương với tỷ lệ đáp ứng virus kéo dài trong các thử nghiệm để đăng ký .
4.11.2. Điều trị hỗ trợ
Trước khi khởi đầu trị liệu kháng virus, bệnh nhân phải được hướng dẫn về lịch trình và các tác dụng phụ có thể gặp trong quá trình điều trị. Bệnh nhân cũng nên được hướng dẫn về các biện pháp phòng ngừa và điều trị để giảm nhẹ các tác dụng phụ này, ví dụ bằng cách sử dụng thuốc hạ sốt, thuốc giảm đau hoặc thuốc chống trầm cảm (xem dưới đây). Phải lên lịch thăm khám theo dõi thường xuyên để cho các vấn đề về diễn tiến điều trị và xử trí liên quan đến các tác dụng phụ có thể được thảo luận. Nên tạo điều kiện cho bệnh nhân dễ dàng gặp bác sĩ hoặc điều dưỡng chuyên khoa trong trường hợp xảy ra các tác dụng phụ nhằm làm giảm tỷ lệ ngừng thuốc đến mức tối thiểu. Nên thiết lập quy trình nhắc nhở bệnh nhân trong trường hợp quên cuộc hẹn tái khám.
4.11.3. Điều chỉnh các đồng yếu tố
Thể trọng. Thể trọng (Chỉ số khối cơ thể, BMI) ảnh hưởng bất lợi đến đáp ứng với pegylated IFN-α và ribavirin, ngay cả sau khi điều chỉnh liều IFN và ribavirin . Giảm cân trước khi điều trị được khuyến cáo và đã có liên quan với tỷ lệ đáp ứng virus kéo dài tốt hơn.
Uống rượu. Do việc thường xuyên uống rượu sẽ dẫn đến tăng tiến triển xơ hóa và có thể làm giảm đáp ứng với trị liệu kháng virus, điều quan trọng là đảm bảo rằng bệnh nhân kiêng việc uống rượu thường xuyên. Nếu bệnh nhân không thể kiêng việc uống rượu thường xuyên, nên cố gắng điều trị chứng nghiện rượu trước khi khởi đầu trị liệu kháng virus và bệnh nhân nên được hỗ trợ thêm trong suốt quá trình trị liệu kháng virus để họ có thể tuân thủ liệu trình điều trị đầy đủ . Bệnh nhân nên được tư vấn kiêng hoàn toàn việc uống rượu trong khi điều trị kháng virus hoặc, ít ưa thích hơn, ít nhất là phải giảm uống rượu đến mức chỉ thỉnh thoảng uống lượng nhỏ.
Đề kháng insulin. Sự đề kháng insulin có liên quan với tiến triển xơ hóa trong bệnh viêm gan C mạn tính và chỉ số HOMA tăng cho thấy là yếu tố dự báo độc lập về thất bại điều trị ở những bệnh nhân được điều trị bằng pegylated IFN-α và ribavirin . Cho đến nay không có thử nghiệm nghiên cứu theo thời gian nào có quy mô thích hợp được công bố để chứng minh hiệu quả của một can thiệp trị liệu nhằm cải thiện sự đề kháng insulin trong đáp ứng virus kéo dài. Vì vậy, còn sớm để đưa ra bất kỳ khuyến cáo nào về việc dùng các thuốc làm giảm sự đề kháng insulin và cần tiến hành các thử nghiệm thích hợp.
4.11.4. Điều trị hỗ trợ
Yếu tố tăng trưởng. Việc sử dụng yếu tố tăng trưởng đã được đề nghị để giúp hạn chế sự giảm liều điều trị.
Erythropoietin tái tổ hợp có thể được dùng để duy trì hoặc cải thiện nồng độ hemoglobin nhằm tránh việc giảm liều hoặc ngừng ribavirin là trường hợp cho thấy liên quan với tỷ lệ thất bại điều trị cao hơn. Mặc dù cho đến nay chưa có thử nghiệm nghiên cứu theo thời gian nào được thiết lập để chứng minh chắc chắn rằng việc sử dụng erythropoietin có ảnh hưởng tích cực trên đáp ứng virus kéo dài, nó vẫn được sử dụng rộng rãi trên toàn thế giới để duy trì liều cao ribavirin và cải thiện sức khỏe của bệnh nhân . Erythropoietin có thể được dùng khi nồng độ hemoglobin giảm dưới 10 g/dl. Nên tái đánh giá nồng độ hemoglobin 2 tuần sau khi khởi đầu liệu pháp erythropoietin. Ở thời điểm này, nên giảm liều erythropoietin nếu hemoglobin tăng hơn 1g/dl và ngừng dùng nếu nồng độ hemoglobin tăng cao hơn 12 g/dl. Nên tái đánh giá nồng độ hemoglobin 4 tuần sau đó. Nên giảm liều erythropoietin nếu nồng độ hemoglobin tăng cao hơn 2 g/dl so với 4 tuần trước đó, và nên ngừng dùng erythropoietin nếu nồng độ hemoglobin cao hơn 12 g/dl. Trong trường hợp này, có thể bắt đầu lại liệu pháp erythropoietin ở liều bằng 50% liều khởi đầu nếu nồng độ hemoglobin giảm xuống dưới 12 g/dl. Nếu nồng độ hemoglobin tăng ít hơn 1 g/dl tại thời điểm 4 tuần sau khi dùng và không tìm thấy nguyên nhân khác gây thiếu máu, có thể tăng liều erythropoietin.
Không có bằng chứng rõ ràng cho thấy giảm bạch cầu trung tính trong quá trình điều trị bằng pegylated IFN-α và ribavirin là một phản ứng thường gặp trên bệnh nhân xơ gan, gây ra tác dụng có hại. Ngoài ra, không có bằng chứng từ các thử nghiệm nghiên cứu theo thời gian về việc sử dụng yếu tố kích thích dòng tế bào hạt (G-CSF) làm giảm tỷ lệ nhiễm trùng và/hoặc cải thiện tỷ lệ đáp ứng virus kéo dài. Mặc dù G-CSF được sử dụng ở một số nước ở châu Âu ngay khi số lượng bạch cầu trung tính giảm xuống dưới 750-500/mm3, không có đủ bằng chứng để khuyến cáo áp dụng phương pháp này như một điều trị chuẩn.
Một chất đồng vận thụ thể thrombopoetin đã cho thấy có thể làm tăng số lượng tiểu cầu trước điều trị ở những bệnh nhân xơ gan liên quan đến HCV bị giảm tiểu cầu . Tỷ lệ ngừng điều trị do giảm tiểu cầu hiếm gặp và những bệnh nhân có số lượng tiểu cầu thấp thường có thể được bắt đầu liệu pháp pegylated IFN-α và ribavirin mà không tăng các giai đoạn chảy máu nặng. Cho đến khi đáp ứng virus kéo dài có thể cho thấy được cải thiện do sự cải thiện số lượng tiểu cầu, không có khuyến cáo nào về việc sử dụng thuốc kích thích tiểu cầu. Nguy cơ huyết khối tĩnh mạch cửa trong quá trình điều trị với eltrombag - là thuốc kích thích chất đồng vận thụ thể thrombopoietin cần được xem xét .
Thuốc chống trầm cảm: Trầm cảm ảnh hưởng có hại nặng nề đến chất lượng cuộc sống liên quan đến sức khỏe trong khi trị liệu bằng pegylated IFN-α và ribavirin và là lý do thường gặp nhất gây ngừng điều trị trong các thử nghiệm then chốt. Những bệnh nhân có tiền sử và/hoặc dấu hiệu trầm cảm nên đến gặp bác sĩ chuyên khoa tâm thần trước khi bắt đầu điều trị để đánh giá nguy cơ và các chống chỉ định có thể có. Sau đó họ nên được theo dõi nếu cần thiết. Điều trị chống trầm cảm nên bắt đầu trong khi trị liệu nếu cảm thấy thích hợp, và cần theo dõi thích hợp để quyết định có phải cần ngừng điều trị hay không. Điều trị chống trầm cảm dự phòng có thể được bàn luận do hiệu quả của nó trong việc làm giảm tỷ lệ trầm cảm trong quá trình điều trị đã được báo cáo mà không có ảnh hưởng nào trên đáp ứng virus kéo dài. Tăng nhạy cảm với tính dễ bị kích thích và lo âu vì mất ngủ do IFN-α không nên bị nhầm lẫn với trầm cảm và nên được điều trị thích hợp bằng thuốc chống lo âu hơn là thuốc ngủ hoặc thuốc chống trầm cảm .
Khuyến cáo
4.12. Theo dõi sau điều trị trên bệnh nhân đạt đáp ứng virus kéo dài
Những bệnh nhân không bị xơ gan đạt đáp ứng virus kéo dài nên được kiểm tra lại nồng độ ALT và HCV RNA tại thời điểm 48 tuần sau khi điều trị và 1 năm sau đó. Nếu ALT vẫn bình thường và không phát hiện được HCV RNA, bệnh nhân có thể được xuất viện dưới dạng được chữa khỏi. Do chứng cường giáp có thể xảy ra sau khi ngừng điều trị, nồng độ TSH và thyroxin cũng nên được đánh giá 1 năm sau khi điều trị. Ngoài ra, bệnh nhân xơ gan phải được theo dõi giãn tĩnh mạch thực quản mỗi 1-2 năm và ung thư biểu mô tế bào gan mỗi 6 tháng bằng chụp siêu âm và α-fetoprotein. Không cần kiểm tra lại HCV RNA.
Khuyến cáo
4.13. Tái điều trị những người không đạt được đáp ứng virus kéo dài với pegylated IFN-α và ribavirin
Những người không đạt được đáp ứng virus kéo dài với liệu trình pegylated IFN-α và ribavirin trước đó và bị nhiễm HCV genotype 1 chỉ có khả năng thấp để đạt được đáp ứng virus kéo dài; khi tái điều trị với cùng loại thuốc và cùng liều, khả năng này không quá 10-15% đối với những người không đáp ứng và 30-40% đối với những người tái phát. Vì vậy, những bệnh nhân này nên được hoãn việc tái điều trị và được đánh giá lại việc điều trị bằng thuốc kháng virus tác động trực tiếp (ví dụ: chất ức chế protease của HCV) kết hợp với pegylated IFN-α và ribavirin ngay khi những thuốc này có sẵn.
Thế hệ chất ức chế HCV protease đầu tiên tức là telaprevir và boceprevir không hiệu quả và không được chấp thuận để sử dụng ở các genotype không phải 1. Vì vậy những bệnh nhân không đáp ứng với genotype không phải 1 có thể tái điều trị với pegylated IFN-α và ribavirin nếu họ có chỉ định điều trị khẩn cấp, và/hoặc nếu có bằng chứng là tiếp xúc không đủ với pegylated IFN-α hoặc ribavirin không đủ do sự điều chỉnh liều hoặc tuân thủ điều trị kém trong liệu trình điều trị đầu tiên. Thời gian tái điều trị dài hơn (48 tuần đối với genotype 2 và 3, 72 tuần đối với genotype 4) có thể áp dụng, đặc biệt trên bệnh nhân có đáp ứng virus chậm và tái phát trong chu kỳ điều trị đầu tiên . Với sự phát triển lâm sàng hiện tại của các thuốc mới điều trị nhiễm HCV mạn tính, người ta khuyến cáo rằng bất cứ khi nào có thể, những bệnh nhân không đáp ứng với liệu trình pegylated IFN-α và ribavirin đầu tiên nên được bao gồm vào các thử nghiệm lâm sàng với các thuốc mới này.
Điều trị duy trì với liều thấp pegylated IFN-α không được khuyến cáo do điều này cho thấy không có hiệu quả nói chung trong phòng ngừa biến chứng của viêm gan C mạn tính về lâu dài . Các dữ liệu gần đây từ một phân tích đoàn hệ HALT-C mở rộng cho thấy rằng liệu pháp peginterferon dài hạn làm giảm nhẹ tỷ lệ ung thư biểu mô tế bào gan trên các bệnh nhân xơ gan được điều trị với peginterferon, bất kể họ có đạt được đáp ứng virus kéo dài hay không . Tuy nhiên, xem xét tác dụng có lợi ít, tác dụng phụ và chi phí của peginterferon, việc sử dụng liệu pháp duy trì bằng peginterferon vẫn còn bị nghi ngờ.
Khuyến cáo
4.14. Điều trị những bệnh nhân bị bệnh gan nặng
4.14.1 Xơ gan còn bù
Những bệnh nhân xơ gan còn bù phải được điều trị khi không có chống chỉ định nhằm phòng ngừa các biến chứng do nhiễm HCV mạn tính xảy ra riêng đối với nhóm này cấp thời hoặc giữa kỳ. Thật vậy, các nghiên cứu đoàn hệ lớn và phân tích tổng hợp đã cho thấy là đáp ứng virus kéo dài ở những bệnh nhân bị xơ hóa tiến triển có liên quan với giảm đáng kể tỷ lệ mất bù và ung thư biểu mô tế bào gan trên lâm sàng. Tuy nhiên, tỷ lệ đáp ứng virus kéo dài với pegylated IFN-α và ribavirin thấp hơn ở những bệnh nhân bị xơ hóa tiến triển hoặc xơ gan so với những bệnh nhân bị xơ hóa nhẹ đến trung bình. Vì vậy, cũng có thể xác đáng khi chờ đợi sự phê duyệt liệu pháp 3 thuốc với chất ức chế protease (genotype 1) nếu dự đoán được lợi ích tại chỗ của chúng trong vòng vài tháng.
Cần theo dõi liên tục và xử trí các tác dụng phụ ở nhóm bệnh nhân này là những người thường cao tuổi và có sự dung nạp thấp hơn so với những bệnh nhân có bệnh gan tiến triển ít hơn. Do tăng áp lực tĩnh mạch cửa và cường lách, số lượng bạch cầu và tiểu cầu ở mức cơ bản có thể thấp trên bệnh nhân xơ gan. Các tác dụng phụ về huyết học thường gặp hơn ở bệnh nhân xơ gan so với bệnh nhân không xơ gan và có thể chống chỉ định điều trị. Các yếu tố tăng trưởng có thể hữu ích trong nhóm này.
Không kể việc đạt được đáp ứng virus kéo dài, những bệnh nhân bị xơ gan cần được giám sát thường xuyên về sự xuất hiện ung thư biểu mô tế bào gan (HCC) và tăng áp lực tĩnh mạch cửa, vì nguy cơ gặp biến chứng giảm nhưng không mất đi khi tiệt trừ nhiễm HCV.
Khuyến cáo
(1) Những bệnh nhân bị xơ gan mất bù nên được điều trị, khi không có chống chỉ định, để phòng ngừa các biến chứng giữa kỳ (A1).
(2) Cần theo dõi liên tục và và xử trí các tác dụng phụ, đặc biệt là những trường hợp liên quan đến tăng áp lực tĩnh mạch cửa và cường lách. Các yếu tố tăng trưởng có thể hữu ích trong nhóm này (C2).
(3) Những bệnh nhân bị xơ gan cần được giám sát thường xuyên về sự xuất hiện ung thư biểu mô tế bào gan, bất kể đáp ứng virus kéo dài (B1).
4.14.2. Bệnh nhân có chỉ định ghép gan
Ghép gan là phương pháp điều trị lựa chọn đối với những bệnh nhân bị bệnh gan giai đoạn cuối. Tuy nhiên, tái phát viêm gan C do nhiễm khuẩn mảnh ghép là phổ biến sau ghép . Điều trị chống virus ở những bệnh nhân đang chờ ghép phòng ngừa nhiễm khuẩn mảnh ghép nếu đạt được đáp ứng virus kéo dài . Hơn một nửa bệnh nhân có chống chỉ định dùng pegylated IFN-α và ribavirin, và kết quả điều trị thường kém ở nhóm bệnh nhân này với bệnh gan tiến triển hoặc mất bù. Liệu pháp kháng virus được chỉ định ở bệnh nhân có chức năng gan được bảo tồn (Child-Pugh A), ở những người này chỉ định ghép gan là ung thư biểu mô tế bào gan. Ở bệnh nhân bị xơ gan Child-Pugh B, có thế áp dụng liệu pháp kháng virus trên cơ sở từng bệnh nhân ở những trung tâm có kinh nghiệm, ưu tiên ở những bệnh nhân có yếu tố dự đoán đáp ứng tốt như bệnh nhân nhiễm HCV genotype 2 hoặc 3, hoặc những bệnh nhân có nồng độ HCV RNA cơ bản thấp. Bệnh nhân bị xơ gan Child-Pugh C không nên được xử trí bằng điều trị chuẩn, do nguy cơ cao về các biến chứng đe dọa tính mạng .
Đối với những người bị bệnh gan nặng có thể điều trị trước khi ghép, nên bắt đầu liệu pháp kháng virus vào thời điểm được đưa vào danh sách, với mục tiêu đạt được đáp ứng virus kéo dài , hoặc trong khi chờ ghép gan để đạt được sự làm sạch HCV-RNA vào thời điểm ghép . Khoảng 75% bệnh nhân đã trở về HCV RNA âm tính vào thời điểm ghép vẫn âm tính sau ghép. Có thể bắt đầu điều trị với liều thấp pegylated IFN-α và ribavirin theo chế độ điều trị liều thấp tăng lên, hoặc với liều đầy đủ, nếu có thể được. Trong trường hợp thứ hai, cần giảm liều và ngừng điều trị trong hơn 50% trường hợp. Các tác dụng phụ về huyết học (thiếu máu, giảm bạch cầu trung tính và giảm tiểu cầu) đặc biệt thường gặp ở những bệnh nhân bị bệnh gan giai đoạn cuối do tăng áp lực tĩnh mạch cửa. Vì vậy, việc điều trị đòi hỏi theo dõi sát và điều chỉnh liều. Việc sử dụng yếu tố tăng trưởng (erythropoietin và G-CSF) có thể hữu ích để kiểm soát các tác dụng phụ về huyết học.
Khuyến cáo
(1) Ở những bệnh nhân đang chờ ghép gan, việc điều trị kháng virus khi có thể thực hiện được sẽ phòng ngừa sự tái nhiễm khuẩn mảnh ghép nếu đạt được đáp ứng virus kéo dài (B1). Nhiều bệnh nhân có chống chỉ định với điều trị và kết quả điều trị thường kém ở nhóm bệnh nhân này với bệnh gan tiến triển mạnh (B1).
(2) Có thể bắt đầu liệu pháp kháng virus vào thời điểm được đưa vào danh sách hoặc trong khi chờ ghép gan (LT), với mục tiêu đạt được đáp ứng virus kéo dài hoặc sự làm sạch HCV-RNA vào trước khi ghép gan (C2).
(3) Liệu pháp kháng virus được chỉ định ở bệnh nhân có chức năng gan được bảo tồn (Child-Pugh A), ở những người này chỉ định ghép gan là ung thư biểu mô tế bào gan (B2).
(4) Ở bệnh nhân bị xơ gan Child-Pugh B, có thế áp dụng liệu pháp kháng virus trên cơ sở từng bệnh nhân ở những trung tâm có kinh nghiệm, ưu tiên ở những bệnh nhân có yếu tố dự đoán đáp ứng tốt (C2). Nên dùng norfloxacin dự phòng nếu có cổ trướng (C2).
(5) Bệnh nhân bị xơ gan Child-Pugh C không nên được xử trí bằng chế độ điều trị kháng virus hiện hành, do nguy cơ cao về các biến chứng đe dọa tính mạng (C1).
(6) Có thể bắt đầu điều trị với liều thấp pegylated IFN-α và ribavirin theo chế độ điều trị liều thấp tăng lên, hoặc với liều đầy đủ, nếu có thể được. Trong trường hợp thứ hai, cần giảm liều và ngừng điều trị trong hơn 50% trường hợp (C2).
4.14.3. Tái phát sau ghép gan
Tái phát nhiễm HCV phổ biến ở những bệnh nhân có HCV RNA có thể phát hiện được vào thời điểm ghép gan . Diễn tiến của bệnh gan liên quan đến HCV tăng lên ở những người nhận ghép gan và khoảng 1/3 trong số bệnh nhân này phát triển xơ gan trong vòng 5 năm sau ghép . Việc điều trị thành công đã cho thấy có tác động tích cực trên cả mảnh ghép và sự sống còn của bệnh nhân.
Những bệnh nhân nhiễm HCV tái phát sau ghép gan nên bắt đầu điều trị một khi viêm gan mạn tính đã được xác định và được chứng minh về mặt mô học; những bệnh nhân này thường có nền tảng tốt hơn để điều trị so với ở giai đoạn cấp của sự tái nhiễm virus và viêm gan liên quan, tức là giảm ức chế miễn dịch, cải thiện tình trạng lâm sàng, đảm bảo sự dung nạp tốt hơn giảm nguy cơ gây thải mảnh ghép nhờ liệu pháp dựa trên IFN. Sự hiện diện xơ hóa hoặc tăng áp lực tĩnh mạch cửa đáng kể lúc 1 năm sau khi ghép gan là yếu tố dự đoán tiến triển nhanh của bệnh, mất mảnh ghép và chỉ định điều trị kháng virus khẩn cấp . Ở những bệnh nhân có bệnh tiến triển ít hơn như những người có sự xơ hóa giới hạn ở bè cửa và không có tăng áp lực tĩnh mạch cửa, chỉ định điều trị phải được cân nhắc dựa trên khả năng tiệt trừ virus kéo dài và nguy cơ bị các biến chứng do sử dụng pegylated IFN-α và ribavirin. Tuy nhiên, những bệnh nhân này có cơ hội tốt hơn về đáp ứng virus kéo dài so với những người bị bệnh tiến triển nhiều hơn.
Khả năng đáp ứng virus kéo dài trong bối cảnh sau ghép gan theo thứ tự là 30% về tổng thể, với tỷ lệ đáp ứng tốt hơn ở bệnh nhân bị nhiễm HCV genotype 2 hoặc 3 so với genotype 1 . Vì suy thận thường ặp ở người nhận ghép gan, cần điều chỉnh liều ribavirin tương ứng. Hiệu quả tương đối thấp của liệu pháp pegylated IFN-α và ribavirin ở người nhận ghép bị nhiễm HCV ít nhất một phần là do tỷ lệ cao về các tác dụng phụ dẫn đến việc thường xuyên điều chỉnh liều và gián đoạn điều trị. Thiếu máu là nguyên nhân thường gặp nhất gây gián đoạn điều trị trong bối cảnh này (10-40% bệnh nhân) . Vì vậy, việc sử dụng erythropoietin có thể được khuyến cáo trong trường hợp này. Thải mảnh ghép hiếm gặp nhưng có thể xảy ra trong thời gian điều trị bằng IFN-α. Nên tiến hành sinh thiết gan bất cứ khi nào các xét nghiệm gan xấu đi trong tiến trình điều trị kháng virus để chẩn đoán và hướng dẫn quyết định điều trị. Không có chứng cứ về sự hữu ích của liệu pháp duy trì bằng pegylated IFN-α liều thấp ở những bệnh nhân không đạt được đáp ứng virus kéo dài.
Khuyến cáo
(1) Những bệnh nhân nhiễm HCV tái phát sau ghép gan nên bắt đầu điều trị một khi viêm gan mạn tính đã được xác định và được chứng minh về mặt mô học (B2). Xơ hóa hoặc tăng áp lực tĩnh mạch cửa đáng kể lúc 1 năm sau khi ghép gan là yếu tố dự đoán tiến triển nhanh của bệnh, mất mảnh ghép và chỉ định điều trị kháng virus khẩn cấp (B2).
(2) Không có chứng cứ về sự hữu ích của liệu pháp duy trì bằng pegylated IFN-α liều thấp ở những bệnh nhân không đạt được đáp ứng virus kéo dài (C2).
(3) Thải mảnh ghép hiếm gặp nhưng có thể xảy ra trong thời gian điều trị bằng IFN-α. Nên tiến hành sinh thiết gan bất cứ khi nào các xét nghiệm gan xấu đi trong tiến trình điều trị kháng virus để chẩn đoán và hướng dẫn quyết định điều trị (C2).
4.15. Điều trị các nhóm bệnh nhân đặc biệt
4.15.1 Đồng nhiễm HIV
Sự tiến triển của bệnh gan tăng nhanh ở những bệnh nhân bị đồng nhiễm HIV-HCV, đặc biệt ở những người có số lượng tuyệt đối của tế bào CD4 thấp và chức năng miễn dịch suy giảm. Vì lý do này, nên xem xét điều trị kháng virus sớm ở những bệnh nhân bị đồng nhiễm HIV-HCV. Nếu bệnh nhân bị suy giảm miễn dịch nặng, có số lượng tuyệt đối của tế bào CD4 < 200 tế bào/μl, cần cải thiện số lượng tế bào CD4 bằng cách sử dụng điều trị kháng virus rất tích cực trước khi bắt đầu điều trị kháng HCV. Trong khi điều trị bằng pegylated IFN-α và ribavirin, chống chỉ định dùng didanosine. Nên tránh dùng stavudine và zidovudine, trong khi vai trò của abacavir vẫn còn đang tranh luận. Phải đánh giá độ nặng của bệnh gan trước khi điều trị bằng cách sinh thiết gan hoặc bằng phương pháp đánh giá không xâm lấn (xét nghiệm huyết thanh hoặc đo độ đàn hồi tạm thời) .
Chỉ định điều trị HCV giống với chỉ định ở những bệnh nhân nhiễm một loại virus HCV . Chế độ điều trị tương tự bằng pegylated IFN-α nên được sử dụng ở những bệnh nhân đồng nhiễm HIV như ở những bệnh nhân không nhiễm HIV. Nên dùng liều ribavirin theo cân nặng (15 mg/kg/ngày), cho dù genotype nào của HCV . Theo dõi động học của virus khi điều trị cần được thực hiện và nên điều trị bệnh nhân theo đáp ứng virus của họ vào tuần thứ 4 và 12. Tỷ lệ đáp ứng virus kéo dài thường thấp hơn ở những bệnh nhân nhiễm một loại virus, tỷ lệ với genotype HCV . Những bệnh nhân bị nhiễm virus có genotype 2 hoặc 3 với nồng độ HCV-RNA lúc ban đầu thấp (< 400.000 IU/ml) và xơ hóa nhẹ là những người đạt được đáp ứng virus kéo dài có thể chỉ cần 24 tuần điều trị. Những bệnh nhân khác cần 48 tuần điều trị và việc trị liệu nên mở rộng đến 72 tuần ở những bệnh nhân vẫn còn HCV-RNA dương tính ở tuần thứ 12 (DVR), cho dù genotype nào của HCV.
Khuyến cáo
(1) Chỉ định điều trị HCV giống với chỉ định ở những bệnh nhân nhiễm một loại virus HCV [B2].
(2) Chế độ điều trị tương tự bằng pegylated IFN-α nên được sử dụng ở những bệnh nhân đồng nhiễm HIV như ở những bệnh nhân không nhiễm HIV, nhưng liều ribavirin nên luôn dựa trên cân nặng (B2).
(3) Thời gian điều trị kéo dài (72 tuần đối với genotype 1 và 48 tuần đối với genotype 2 và 3) có thể cần thiết (B2).
4.15.2. Đồng nhiễm HBV
Ở những bệnh nhân bị đồng nhiễm HCV-HBV, nồng độ HBV DNA thường thấp hoặc không phát hiện được, mặc dù nó có thể dao động lớn, và HCV thường điều khiển chính hoạt động viêm gan mạn tính. Cần xác định tình trạng sao chép của cả HBV và HCV và loại trừ nhiễm virus viêm gan delta. Khi HCV đang sao chép và gây bệnh gan, cần điều trị bằng pegylated IFN-α và ribavirin theo cùng nguyên tắc như ở bệnh nhân nhiễm một loại virus. Tỷ lệ đáp ứng virus kéo dài ở nhóm này nói chung tương đương hoặc thậm chí cao hơn tỷ lệ đáp ứng virus kéo dài ở những bệnh nhân nhiễm một loại virus HCV . Có nguy cơ tiềm ẩn về tái hoạt HBV trong hoặc sau khi sạch HCV . Trong trường hợp đó, hoặc nếu sự sao chép HBV có thể phát hiện được ở nồng độ đáng kể, điều trị đồng thời bằng chất tương tự nucleoside/nucleotide của HBV có thể được chỉ định. Đối với telbivudine, đã có báo cáo về khả năng tăng độc tính liên quan đến bệnh thần kinh khi được dùng kết hợp với IFN.
Khuyến cáo
(1) Bệnh nhân nên được điều trị bằng pegylated IFN-α và ribavirin theo cùng nguyên tắc như ở bệnh nhân nhiễm một loại virus (B2).
(2) Nếu HBV sao chép ở nồng độ đáng kể trước, trong hoặc sau khi sạch HCV, điều trị đồng thời bằng chất tương tự nucleoside/nucleotide của HBV được chỉ định (C2).
4.15.3. Điều trị bệnh nhân có bệnh đi kèm
Bệnh nhân thẩm phân máu. Do ảnh hưởng dài hạn bất lợi của sự nhiễm HCV sau ghép và do thiếu lựa chọn điều trị hiện nay đối với HCV sau ghép thận, nên cố gắng điều trị bệnh nhân thẩm phân máu, nếu có thể được. Ribavirin bị loại bỏ qua thận. Vì vậy, những bệnh nhân thẩm phân máu đã được điều trị bằng đơn trị liệu pegylated IFN-α với các liều thường dùng . Khi không có ribavirin, tỷ lệ đáp ứng virus kéo dài thấp hơn đáng kể ở bệnh nhân không thẩm phân máu. Tỷ lệ ngừng đơn trị liệu pegylated IFN-α từ 30% - 50% đã được báo cáo. Việc lựa chọn bệnh nhân cẩn thận và xử trí các tác dụng phụ là điều quan trọng. Điều trị kết hợp với pegylated IFN-α và ribavirin có thể được xem xét bởi các bác sĩ có kinh nghiệm, với các liều ribavirin theo từng bệnh nhân là 200 mg/ngày – 200 mg/2 ngày một lần và hỗ trợ tạo máu đáng kể, như đã được đề nghị bởi một số nghiên cứu sơ bộ. Vì PegIFN-alph 2a bị loại bỏ qua gan và PegIFN-alpha2b chủ yếu qua thận, có thể có sự tích lũy PegIFN-alpha2b trên lý thuyết khi được dùng ở bệnh nhân thẩm phân máu, có thể gây ra các tác dụng phụ nhiều hơn hoặc tăng hiệu quả . Mặc dù điều này không được so sánh chính thức, không quan sát thấy sự khác biệt rõ rệt nào về mặt lâm sàng.
Người nhận ghép tạng đặc không phải gan. Nhiễm HCV ở những người nhận ghép thận có liên quan với tăng nguy cơ tiến triển xơ hóa và tử vong liên quan đến gan. Vì xơ gan là một yếu tố dự báo quan trọng về tỷ lệ sống còn kém sau ghép trong trường hợp sau ghép thận, nên đạt được sinh thiết gan từ những đối tượng ghép thận dương tính với HCV . Điều trị nhiễm HCV mạn tính bằng pegylated IFN-α và ribavirin ở người nhận ghép thận có liên quan với nguy cơ loại bỏ tế bào cấp hoặc mạn tính trong 30% trường hợp hoặc nhiều hơn, dẫn đến thải mảnh ghép và giảm tỷ lệ sống còn của bệnh nhân. Vì vậy, điều trị bằng pegylated IFN-α và ribavirin có các nguy cơ thêm ở những bệnh nhân này và chỉ định điều trị phải được điều chỉnh tương ứng. Những đối tượng có chỉ định ghép thận nên được điều trị viêm gan C trước khi ghép .
Các dữ liệu về nhiễm HCV sau ghép tim ít và đang được tranh luận, với các nghiên cứu cho thấy tỷ lệ sống còn không thay đổi hoặc giảm ở những bệnh nhân bị nhiễm HCV. Chưa có nghiên cứu về nguy cơ và lợi ích của liệu pháp kháng virus ở những bệnh nhân này và nguy cơ thải mảnh ghép khi điều trị bằng IFN-α vẫn còn chưa rõ. Trong bối cảnh này, việc điều trị nhiễm HCV mạn tính ở người nhận ghép tim không thể được khuyến cáo và chỉ định cần được đánh giá trên cơ sở từng trường hợp, nếu nhiễm HCV đe dọa tính mạng.
Các hướng dẫn quốc tế liệt kê nhiễm HCV mạn tính là một chống chỉ định tuyệt đối với ghép phổi . Một số tác giả khuyến cáo điều trị các đối tượng ghép phổi trước khi ghép, nhưng kinh nghiệm còn hạn chế với cách tiếp cận này. Chưa có dữ liệu về ảnh hưởng của nhiễm HCV và việc điều trị bệnh này sau ghép tụy hoặc ghép ruột non.
Lạm dụng rượu. Uống rượu lâu dài ở bệnh nhân viêm gan C mạn tính có liên quan với xơ hóa tiến triển nhanh, tần suất xơ gan cao hơn và tỷ lệ mắc ung thư biểu mô tế bào gan (HCC) cao hơn . Tỷ lệ đáp ứng virus kéo dài thấp hơn ở những bệnh nhân lạm dụng rượu [113]. Tuy nhiên, ít nhất là uống rượu trung bình đã được tìm thấy ở 2/3 bệnh nhân bị viêm gan C mạn tính và chỉ một nửa trong số họ ngừng uống rượu do được tư vấn và bắt đầu điều trị. Chưa rõ ảnh hưởng lên đáp ứng với điều trị chuẩn (SoC). Không nên loại bệnh nhân uống rượu ra khỏi điều trị nhưng nên được tư vấn để họ ngừng uống rượu và được hỗ trợ thêm để cải thiện sự tuân thủ trong khi điều trị.
Lạm dụng ma túy.Hiện có một ít dữ liệu về việc điều trị những người sử dụng hoạt chất ma túy, do quan niệm được chấp nhận rộng rãi là bệnh nhân nên được điều trị không dùng thuốc hoặc điều trị thay thế ổn định trong ít nhất 6-12 tháng. Không có khuyến cáo chung nào về việc điều trị những người sử dụng hoạt chất ma túy có thể được đưa ra. Cách tiếp cận theo từng cá thể sau khi đánh giá và theo dõi sát đã được khuyến cáo bởi một nhóm nghiên cứu đa ngành giàu kinh nghiệm gồm các bác sĩ chuyên khoa gan và bác sĩ điều trị cai nghiện .
Bệnh nhân đang điều trị thay thế duy trì ổn định. Những người nghiện ma túy đang điều trị thay thế bằng methadone dường như không có tỷ lệ đáp ứng virus kéo dài thấp hơn khi điều trị bằng pegylated IFN-α và ribavirin. Tuy nhiên, ngừng thuốc trong 8 tuần đầu điều trị dường như hơi thường xuyên hơn . Ở những bệnh nhân này, nên thiết lập điều trị kháng virus sau khi đánh giá cẩn thận từng bệnh nhân bởi một nhóm nghiên cứu liên ngành gồm các
bác sĩ chuyên khoa gan và bác sĩ điều trị cai nghiện. Khuyến cáo theo dõi sát và hỗ trợ cho việc tuân thủ điều trị và về sức khỏe tinh thần.
Bệnh hemoglobin. Bệnh hemoglobin thường gặp nhất liên quan với viêm gan C là bệnh thalassemia nặng là trường hợp đòi hỏi truyền máu thường xuyên và thường gặp ở những nước mà sự sàng lọc nguồn cung cấp máu có thể ít nghiêm ngặt hơn ở các nước đã công nghiệp hóa. Trong một số thử nghiệm lâm sàng đã được công bố, những bệnh nhân này có tỷ lệ bị thiếu máu cao hơn và tích lũy sắt khi dùng kết hợp chuẩn pegylated IFN-α và ribavirin. Vì vậy, họ có thể được điều trị bằng liệu pháp kết hợp chuẩn nhưng cần xử trí cẩn thận những biến chứng này bằng các yếu tố tăng trưởng, truyền máu và liệu pháp chelate hóa sắt khi cần thiết .
Nhiễm HCV mạn tính thường gặp ở những người bị bệnh thiếu máu hồng cầu hình liềm, là hậu quả của một số lần được truyền máu. Không có thử nghiệm nào về điều trị kháng virus đã được công bố ở nhóm bệnh nhân này. Những trường hợp riêng lẻ đã được điều trị thành công bằng sự kết hợp pegylated IFN-α và ribavirin.
Khuyến cáo
(1) Những bệnh nhân đang thẩm phân máu có thể được điều trị an toàn bằng đơn trị liệu Peg- IFN (A2). Điều trị kết hợp bằng các liều ribavirin theo từng cá thể có thể được xem xét ở những bệnh nhân được chọn (C2).
(2) Những bệnh nhân bị nhiễm HCV và bệnh thận giai đoạn cuối được lên lịch ghép thận nên được điều trị kháng virus trước khi ghép thận do tăng nguy cơ thải ghép cấp (B2).
(3) Nên phản đối mạnh mẽ việc uống rượu thường xuyên (A1).
(4) Điều trị bệnh nhân lạm dụng hoạt chất ma túy bị cấm phải được quyết định trên cơ sở từng bệnh nhân và nên được tiến hành ở một nhóm nghiên cứu liên ngành cùng với các bác sĩ điều trị cai nghiện (C2).
(5) Điều trị bệnh nhân lạm dụng hoạt chất ma túy bị cấm đang được điều trị thay thế duy trì ổn định có thể được thực hiện an toàn ở một nhóm nghiên cứu liên ngành bao gồm các bác sĩ điều trị cai nghiện và đem lại tỷ lệ đáp ứng virus kéo dài chỉ hơi giảm so với những bệnh nhân nhiễm HCV thông thường (B2).
(6) Những bệnh nhân bị bệnh hemoglobin có thể được điều trị bằng liệu pháp kết hợp nhưng cần theo dõi cẩn thận đối với các tác dụng phụ về huyết học (C2).
4.16. Theo dõi bệnh nhân chưa được điều trị và những người không có đáp ứng kéo dài
Những bệnh nhân bị viêm gan C mạn tính chưa được điều trị và những người không đáp ứng với các chu kỳ điều trị trước đó cần được theo dõi thường xuyên. Các hướng dẫn trước đây khuyến cáo thực hiện sinh thiết gan mỗi 3-5 năm. Bằng các phương pháp không xâm lấn, có thể thực hiện sàng lọc thường xuyên. Vì vậy, nên đánh giá những bệnh nhân chưa được điều trị mỗi 1-2 năm bằng một phương pháp không xâm lấn. Bệnh nhân bị xơ gan cần được sàng lọc đặc biệt để tìm ung thư biểu mô tế bào gan (HCC) mỗi 6 tháng.
Khuyến cáo
(1) Những bệnh nhân bị viêm gan C mạn tính chưa được điều trị và những người không có đáp ứng kéo dài cần được theo dõi thường xuyên (C2).
(2) Việc sàng lọc ung thư biểu mô tế bào gan phải được tiếp tục vô hạn định ở những bệnh nhân bị xơ gan (A2).
4.17. Điều trị viêm gan C cấp tính
Hầu hết bệnh nhân bị viêm gan C cấp tính đều không có triệu chứng, nhưng một tỷ lệ mạn tính cao được dự kiến (50-90%). Bệnh không có triệu chứng, giới nữ, tuổi trẻ, sự làm sạch HCV RNA trong vòng 4 tuần sau khi khởi phát các triệu chứng lâm sàng và tính đa hình về di truyền nằm ở vùng thượng nguồn của gen IL28B có liên quan với sự làm sạch virus tự nhiên, nhưng không có thông số nào trong số này dự đoán chính xác sự khỏi bệnh tự nhiên ở nồng độ theo từng cá thể.
Xác định sớm viêm gan C cấp tính là điều quan trọng, nhưng có thể khó khăn vì bệnh tương đối im lặng. Những bệnh nhân bị viêm gan C cấp tính nên được xem xét về điều trị kháng virus để phòng ngừa tiến triển đến viêm gan C mạn tính. Tỷ lệ đáp ứng virus kéo dài cao (lên đến 905 hoặc thậm chí cao hơn) đã được báo cáo với đơn trị liệu bằng pegylated IFN-α, chủ yếu ở nhóm bệnh nhân không có triệu chứng, bất kể genotype HCV. Những người này thường nên điều trị sớm nhưng hiện chưa có sự đồng thuận. Ở những người dường như không hồi phục lúc 2-4 tháng sau khi khởi phát bệnh, nên xem xét điều trị kháng virus (xem dưới đây) vì một tỷ lệ phần trăm bệnh nhân cao (> 80-90%) có thể đáp ứng, và nguy cơ bệnh mạn tính cao. Điều trị kết hợp với ribavirin không làm tăng tỷ lệ đáp ứng virus kéo dài trong bối cảnh này nhưng có thể được xem xét ở những bệnh nhân mà sự chẩn đoán phân biệt viêm gan cấp tính so với mạn tính không chắc chắn . Yếu tố quyết định quan trọng nhất về sự thiếu đáp ứng trong trường hợp không tuân thủ là ở những bệnh nhân bị viêm gan C cấp tính.
Người ta cũng đề nghị theo dõi những bệnh nhân này bằng cách định lượng HCV RNA mỗi 4 tuần và chỉ điều trị những người vẫn còn dương tính lúc 12 tuần sau khi điều trị ban đầu . Một số bác sĩ lâm sàng có thể thích điều trị khởi đầu sớm hơn nếu HCV RNA cao và không giảm. Điều trị viêm gan C cấp tính thông thường nên dựa trên đơn trị liệu bằng pegylated IFN-α, tức là pegylated IFN-α2a, 180 μg/tuần, hoặc pegylated IFN-α2b, 1,5 μg/kg/tuần trong 24 tuần. Hiện nay không có chỉ định dùng IFN-α dưới dạng dự phòng sau phơi nhiễm khi không có sự lây truyền HCV được chứng minh bằng tài liệu.
Khuyến cáo
(1) Đơn trị liệu bằng pegylated IFN-α (pegylated IFN-α2a, 180 μg/tuần, hoặc pegylated IFN-α2b, 1,5 μg/kg/tuần trong 24 tuần) được khuyến cáo ở những bệnh nhân bị viêm gan cấp tính và đạt được sự tiệt trừ virus > 90% bệnh nhân (B2).
(2) Những bệnh nhân không đáp ứng nên được tái điều trị theo điều trị chuẩn đối với viêm gan C mạn tính (C2).
4.18. Triển vọng của liệu pháp 3 thuốc gồm PEG-interferon, ribavirin và chất ức chế protease
Tiến bộ quan trọng đã được thực hiện trong việc phát triển các phương pháp điều trị mới, đặc biệt là các chất ức chế đặc hiệu hoặc các thuốc kháng virus trực tiếp có hoạt tính chống bệnh viêm gan C. Một số lớn các thử nghiệm nghiên cứu các chất ức chế NS3 protease, NS5A và NS5B polymerase, chất ức chế cyclophilin, các dạng interferon mới, các dẫn xuất của ribavirin và các vacxin điều trị đang được tiến hành. Các nghiên cứu hầu hết hướng đến những bệnh nhân bị nhiễm HCV genotype 1 .
Các thử nghiệm lâm sàng phase III kết hợp pegylated IFN-α, ribavirin và một thuốc kháng virus tác động trực tiếp thuộc họ chất ức chế protease của HCV (telaprevir hoặc bocoprevir) đã được hoàn tất. Những dữ liệu này có khả năng sẽ dẫn đến sự chấp thuận liệu pháp ba thuốc ở những bệnh nhân bị nhiễm HCV genotype 1 là những người chưa được điều trị hoặc không đáp ứng với liệu trình pegylated IFN-α và ribavirin trước đó. Các thử nghiệm then chốt với telaprevir và bocoprevir đã xác nhận tỷ lệ cao hơn đáng kể về bệnh nhân nhiễm virus có genotype 1 chưa được điều trị hoặc không đáp ứng có đáp ứng virus kéo dài, với điều trị dựa trên đáp ứng. Trong một tỷ lệ bệnh nhân có đáp ứng sớm tốt, việc điều trị có thể được rút ngắn đáng kể [41-44]. Telaprevir được dùng 3 lần/ngày. Boceprevir được dùng 3 lần/ngày sau giai đoạn đầu trong 4 tuần dùng PEG-IFN-α cộng ribavirin đơn độc. Ở những bệnh nhân chưa được điều trị, tỷ lệ đáp ứng virus kéo dài là 27-31% cao hơn khi dùng liệu pháp 3 thuốc. Điều trị dựa trên đáp ứng đã được sử dụng; điều trị 24 tuần đối với những bệnh nhân có HCV RNA trở nên âm tính vào các tuần thứ 4 và 12 (eRVR) (telaprevir) hoặc HCV RNA âm tính từ tuần điều trị thứ 8-24 (boceprevir), cần điều trị 48 tuần đối với những bệnh nhân không đạt eRVR. Điều trị ngắn hơn có thể được ở 50-66% bệnh nhân. Những bệnh nhân tái phát trước đây cho thấy tỷ lệ đáp ứng virus kéo dài rất cao 75-86%, trong khi tỷ lệ đáp ứng thấp hơn đối với những người đáp ứng một phần (giảm > 2 log về HCV RNA lúc 12 tuần của liệu pháp trước đó) (50-60%) và những bệnh nhân không đáp ứng trước đó (33%, các dữ liệu chỉ đối với telaprevir) . Các yếu tố liên quan đến đáp ứng với liệu pháp 3 thuốc vẫn đang được xác định: sự xơ hóa tiến triển và chủng tộc người Mỹ gốc Phi đã được xác định là yếu tố dự báo đáp ứng âm tính độc lập.
Các hướng dẫn hiện tại sẽ được cập nhật khi dạng kết hợp này được chấp thuận. Ở những bệnh nhân bị nhiễm HCV có các genotype khác genotype 1, các hướng dẫn hiện hành vẫn sẽ áp dụng.
Khuyến cáo