 |
|
Viêm gan B mạn tính ở trẻ em và thanh thiếu niên
Những điểm chính
Tỷ lệ nhiễm virus viêm gan B (HBV) giảm trong hai thập kỷ qua ở những nước đã thực hiện chương trình tiêm chủng phổ cập
Trẻ sơ sinh, trẻ em và trẻ nhỏ có nguy cơ cao hơn về nhiễm virus mạn tính
Để làm giảm sự lây truyền từ mẹ sang con, trẻ sơ sinh của người mẹ có HBsAg dương tính cần được tiêm vaccin và globulin miễn dịch kháng viêm gan B (HBIG) lúc sinh ra
Lây truyền HBV trực tiếp cho trẻ sơ sinh đã được chủng ngừa thích hợp (nhiễm virus bùng phát) là một vấn đề chưa được giải quyết, đang làm thay đổi sự phân bố genotype của HBV
Viêm gan B mạn tính trong thời thơ ấu là một bệnh nhẹ nhưng có thể dẫn đến xơ gan và ung thư biểu mô tế bào gan (HCC) trong vài trường hợp chưa được xác định rõ
Mục tiêu của trị liệu kháng virus là làm giảm nguy cơ biến chứng liên quan đến nhiễm virus
Đáp ứng với một vài phương pháp điều trị hiện có đối với trẻ em chỉ một phần và giới hạn ở các phân nhóm đặc trưng
Quyết định điều trị nên cân nhắc nguy cơ tiến triển bệnh so với các tác dụng phụ và nguy cơ phát triển sự đề kháng virus
Sự chậm trễ kéo dài trong việc cấp phép cho các loại thuốc mới đã làm hạn chế các lựa chọn điều trị
Nên xem xét điều trị bằng IFNα đối với bệnh nhân có tăng ALT huyết thanh, HBV DNA cao và xơ hóa/viêm từ trung bình đến nặng lúc sinh thiết gan
Trẻ em trong giai đoạn dung nạp miễn dịch không nên được điều trị ngoài các thử nghiệm lâm sàng
Các thử nghiệm lâm sàng ở trẻ em đối với telbivudine, PegIFN và tenofovir hiện đang được tiến hành
I.Mở đầu
Nhiễm virus viêm gan B (HBV) vẫn là một trong những nguyên nhân quan trọng nhất của bệnh gan, với 2 tỷ người bị nhiễm trên toàn thế giới và hơn 600.000 trường hợp tử vong mỗi năm, 94% trường hợp gây ra do xơ gan liên quan với nhiễm virus mạn tính và ung thư biểu mô tế bào gan (HCC) . Tổ chức Y tế thế giới (WHO) ước tính hơn 360 triệu người mang virus mạn tính trên toàn thế giới (6% dân số thế giới). Tỷ lệ nhiễm HBV đã giảm trong hai thập kỷ qua là nhờ việc đưa ra chương trình tiêm chủng phổ cập và việc thực hiện sàng lọc người cho máu. Tuy nhiên, một số lượng đáng kể người lớn và trẻ em vẫn còn bị nhiễm mỗi năm, nhóm thứ hai thường phát triển nhiễm virus mạn tính và đòi hỏi phải theo dõi thích hợp. Mặc dù diễn tiến khá lành tính của bệnh gan mạn tính trong thời thơ ấu và thời niên thiếu, người mang HBV mạn tính có nguy cơ suốt đời về phát triển ung thư biểu mô tế bào gan đến 25% và tỷ lệ xơ gan là 2-3% mỗi năm . Hiện có các trị liệu chống virus an toàn và hiệu quả một phần nhưng chỉ một số ít được cấp phép sử dụng ở trẻ em và việc lựa chọn chính xác đối tượng để điều trị và lựa chọn đúng thời điểm điều trị là cần thiết để tối ưu hóa hiệu quả và làm giảm sự đề kháng virus.
II.Dịch tễ học
Virus viêm gan B (HBV) lây truyền do sự tiếp xúc qua da và niêm mạc với máu, tinh dịch, dịch tiết âm đạo và nước bọt bị nhiễm virus . Khả năng phục hồi cực cao của HBV cho phép virus sống sót hơn 1 tuần trên các bề mặt khô, giải thích sự tăng nguy cơ lây truyền hàng ngang trong gia đình và sự cần thiết tư vấn cho người mang virus và tiêm chủng cho các thành viên trong gia đình . Tuy nhiên, sau 20 năm kể từ khi đưa ra chương trình tiêm chủng, hầu hết trẻ nhỏ và trẻ em đã được bảo vệ chống lại HBV và không nên cách ly người mang virus mạn tính ở trường học hoặc cản trở luyện tập thể thao. Sự lây truyền hiếm xảy ra ở các đơn vị chăm sóc trẻ em nhưng nguy cơ cao hơn ở các trung tâm giam giữ là nơi mà thanh thiếu niên ít có khả năng được chủng ngừa và có các tình huống nguy cơ cao .
Ở các vùng có bệnh lưu hành cao, nhiễm virus xảy ra chủ yếu ở trẻ nhỏ và thời thơ ấu sớm, với sự lây truyền từ mẹ sang con chiếm hơn một nửa các nhiễm virus mạn tính. Sau khi tiếp xúc, nguy cơ phát triển viêm gan B mạn tính cao hơn thực sự đối với trẻ sơ sinh (90%) so với trẻ nhỏ và trẻ em < 5 tuổi (25-30%) hoặc thanh thiếu niên và người lớn (< 5%) . Để làm giảm hơn nữa sự lây truyền từ mẹ sang con, WHO khuyến cáo sử dụng cả vaccin và globulin miễn dịch kháng viêm gan B (HBIG) cho trẻ sơ sinh của người mẹ có HbsAg dương tính trong vòng 24 giờ từ khi sinh ra (tỷ lệ bảo vệ 90-98%) . Sử dụng globulin miễn dịch kháng viêm gan B cho trẻ sơ sinh của người mẹ có HbeAg âm tính không làm thay đổi tỷ lệ bảo vệ chung nhưng làm giảm nguy cơ viêm gan bạo phát (cao hơn ở nhóm này), chứng tỏ có hiệu quả chi phí .
Trẻ sơ sinh của người mẹ có virus huyết cao và HBeAg dương tính có tăng nguy cơ nhiễm HBV mặc dù chủng ngừa thích hợp (nhiễm virus bùng phát) so với trẻ sinh ra từ người mẹ có HbeAg âm tính (16,8% so với 1,6%) và tăng nguy cơ nhiễm virus mạn tính . Nhiễm virus bùng phát có nhiều khả năng xảy ra ở trẻ sơ sinh của người mẹ có genotype C là người có tải lượng virus cao hơn. Vì vậy chương trình tiêm chủng làm thay đổi sự phân bố genotype của HBV . Nhiễm virus trong tử cung, giảm đáp ứng với vaccin và đột biến chống vaccin cũng có thể đóng một vai trò quan trọng. Nguy cơ lây truyền từ mẹ sang con còn phụ thuộc vào nồng độ HBsAg trong huyết thanh người mẹ và cách sinh (10,5% đối với mổ lấy thai tự chọn so với 28% đối với sinh ngã âm đạo) . Có thể làm giảm sự lây truyền trực tiếp hơn nữa bằng cách điều trị người mẹ có virus huyết cao trong 3 tháng cuối của thai kỳ bằng lamivudine, telbivudine hoặc tenofovir (giảm nguy cơ 1-2% đối với lamivudine và 8% đối với telbivudine) .
HBsAg và HBV DNA có thể được phát hiện trong sữa mẹ của người mang virus mạn tính nhưng không có sự tăng nguy cơ lây truyền cho trẻ được nuôi bằng sữa mẹ đã được chứng minh và việc nuôi con bằng sữa mẹ hiện đang được khuyến khích sau khi chủng ngừa thích hợp cho trẻ sơ sinh .
Tổ chức Y tế thế giới (WHO) đã khuyến cáo chủng ngừa HBV phổ cập kể từ năm 1991 với liều đầu tiên được tiêm trong vòng 24 giờ từ khi sinh ra, tiếp theo ít nhất là 2 liều vào lúc 1 tháng tuổi và 6 tháng tuổi . Vào cuối năm 2010, 179 trong số 193 nước thành viên của WHO đã thực hiện một chương trình chủng ngừa HBV cho trẻ em trên toàn quốc và tỷ lệ tiêm chủng vaccin HBV toàn cầu ước tính khoảng 75% . Ở các nước thực hiện chương trình này, tỷ lệ nhiễm HBV giảm đáng kể . Nhiều nước có tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg cao (³ 8%) trước khi thực hiện chương trình tiêm chủng (như Trung Quốc và Đài Loan) hiện nay được xem là có tỷ lệ trung bình (2-7%) hoặc tỷ lệ thấp (< 2%) . Ở Đài Loan, tỷ lệ mang HBsAg ở trẻ em dưới 15 tuổi giảm từ 9,8% xuống còn 0,5% sau 20 năm tiêm chủng . Ở Trung Quốc, tỷ lệ mang HBsAg ở trẻ em từ 1-14 tuổi giảm 83% (từ 8% vào năm 1992 xuống còn 1,36% vào năm 2006) . Trong một nghiên cứu gần đây, 4,6% của tổng dân số Mỹ đã tiếp xúc với HBV (nhiễm virus trước đây hoặc nhiễm virus mạn tính), với sự biến thiên gấp 50 lần theo tuổi, chủng tộc và quốc gia sinh ra. Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg ở trẻ em và thiếu niên từ 6-12 tuổi là 0,03% và từ 13-17 tuổi là 0,02%. Tỷ lệ phơi nhiễm và tình trạng người mang virus mạn tính cao hơn ở những người đến từ các nước có tỷ lệ nhiễm virus cao hoặc trung bình và ở những người có thu nhập gia đình thấp hơn hoặc có hành vi nguy cơ cao.
Mặc dù trong số trẻ em sinh ra ở Tây Âu và Bắc Mỹ, tỷ lệ nhiễm HBV thấp, các bác sĩ nhi khoa và bác sĩ chuyên khoa gan phải đối mặt với sự tăng số lượng trẻ em con nuôi từ các nước có tỷ lệ nhiễm virus cao hơn (Bảng 1). Từ 2% đến 5% của tất cả các trẻ em con nuôi quốc tế, tất cả đến từ ³ 2% vùng có bệnh lưu hành, vẫn còn bị nhiễm HBV . Trung tâm Kiểm soát và phòng ngừa bệnh tật Mỹ (CDC) và Hội Nhi khoa Mỹ khuyến cáo sàng lọc tất cả các trẻ em con nuôi từ những nước này tìm HBV (HBsAg, HBsAb, HBcAb) khi đến nơi và sau 6 tháng để tiêm chủng cho những người không có nồng độ kháng thể bảo vệ (kháng thể kháng HBs ³ 10 mIU/ml) hoặc để chẩn đoán nhiễm virus chưa biết trước đó và tiến hành chủng ngừa cho những người tiếp xúc trong gia đình .10 genotype (A-J) và một số nhóm phụ đã được mô tả đối với HBV có sự phân bố địa lý rõ rệt. Mặc dù genotype A chiếm ưu thế ở hầu hết các nước châu Âu và Bắc Mỹ, nhiều trẻ em trong số trẻ đến từ các nước có bệnh lưu hành cao hoặc trung bình bị nhiễm genotype B, C, D hoặc F (Bảng 1) có tăng nguy cơ bị các biến chứng và có thể có đáp ứng kém hơn với điều trị .
III.Lịch sử tự nhiên
Nhiễm HBV mạn tính được định nghĩa là HBsAg dương tính trong 6 tháng hoặc lâu hơn. Viêm gan B mạn tính (CHB) trong thời thơ ấu là một bệnh nhẹ và trẻ em bị nhiễm bệnh hầu hết không có triệu chứng, có sự tăng trưởng bình thường và khám thực thể bình thường . Hầu hết những đối tượng bị nhiễm chu sinh đều có HBeAg dương tính và nồng độ HBV DNA huyết thanh cao, với alanine aminotransferase (ALT) huyết thanh bình thường hoặc tăng rất nhẹ. Sự truyền HBeAg của mẹ qua nhau thai đã được chứng minh ở cả chuột nhắt và ở người và có thể suy ra sự dung nạp tế bào T hỗ trợ đặc hiệu HBe/HbcAg trong tử cung . Sự dung nạp được gây ra như vậy có thể giải thích tỷ lệ nhiễm virus mạn tính cao hơn ở trẻ sinh ra từ người mẹ có HbeAg dương tính và tỷ lệ nhiễm virus mạn tính khác nhau giữa trẻ sơ sinh và người lớn. Sự tổng hợp số lượng lớn HBeAg bởi virus type hoang dại có thể cần thiết để duy trì sự dung nạp . Giai đoạn dung nạp miễn dịch này được đặc trưng bởi sự sao chép virus cao và tổn thương gan ít, mặc dù ở trẻ em Ý sau 7 năm bị bệnh, 7-10% trẻ cho thấy viêm gan nặng lúc sinh thiết gan và 1,7-4,5% bị xơ gan . Giai đoạn này kéo dài 10-30 năm khi nhiễm virus chu sinh, trong khi nó có thời gian tối thiểu ở những đối tượng bị nhiễm sau này trong cuộc đời.
Các đột biến của virus không có khả năng tiết HBeAg sau đó được chọn lọc từ từ (các đột biến ở vùng trước lõi được phát hiện ở 89% bệnh nhân có HbeAg dương tính) . Sự chọn lọc dường như là thứ phát do các đột biến này có lợi thế hơn HBV type hoang dại, vì các tế bào gan bị nhiễm bởi loại thứ hai nhạy cảm hơn với sự làm sạch virus qua trung gian tế bào lympho T độc tế bào . Sự chọn lọc các đột biến ở vùng trước lõi dẫn đến sự tiết HbeAg thấp hơn. Khi lượng tolerogen tiết ra giảm không đủ để duy trì sự dung nạp miễn dịch, hệ thống miễn dịch bắt đầu tấn công các tế bào gan đã bị nhiễm virus . Nồng độ ALT tăng lên phản ánh sự phát hiện viêm hoại tử nhu mô gan qua sinh thiết và sự biến động nồng độ HBV DNA. Giai đoạn này của viêm gan hoạt động dẫn đến sự chuyển đổi huyết thanh thành kháng thể kháng HBe (anti-Hbe) ở 60-95% bệnh nhân trong thời gian theo dõi dài hạn . Nồng độ ALT tăng đáng kể trước khi làm sạch HBeAg và có thể vẫn còn cao trong vòng 6 tháng sau khi chuyển đổi huyết thanh . Đến 20% của sự chuyển đổi huyết thanh tự phát có thể có các đợt bùng phát ALT trong những năm sau sự chuyển đổi huyết thanh mà dường như có nhiều khả năng ở những đối tượng mang đột biến ở vùng trước lõi . Chuyển đổi huyết thanh tự phát xảy ra sớm hơn và thường xuyên hơn ở những đối tượng mắc phải HBV theo chiều ngang hơn là những đối tượng bị nhiễm virus chu sinh (14-16% so với 4-5% mỗi năm), thường xảy ra sau tuổi dậy thì, với khoảng 90% trẻ em < 15 tuổi vẫn còn có HbeAg dương tính . Người ta thấy rằng các trẻ nam khởi phát dậy thì sớm hơn đã chuyển đổi huyết thanh ở độ tuổi trẻ hơn (13 so với 22 tuổi) cho thấy androgen đóng một vai trò trong quá trình này . Các yếu tố môi trường như tình trạng dinh dưỡng đã được đề xuất là có ảnh hưởng đến đáp ứng miễn dịch với HBV, thúc đẩy sự chuyển đổi huyết thanh ở trẻ em sau khi được nhận làm con nuôi từ các nước phát triển . Tình trạng genotype C và HbeAg dương tính ở người mẹ cũng có liên quan với sự chuyển đổi huyết thanh tự phát chậm.
Những bệnh nhân có HbsAg dương tính, HbeAg âm tính và kháng thể kháng Hbe dương tính được xem là người mang virus không hoạt động, thể hiện không có sự sao chép virus hoặc sao chép virus thấp, với HBV DNA thấp hoặc không phát hiện được và có mô học về gan không hoạt động, với nồng độ ALT bình thường. Những người mang virus không hoạt động không có dấu hiệu xơ gan lúc chuyển đổi huyết thanh không cho thấy tiến triển đến xơ gan sau thời gian theo dõi 24-29 năm .
Bảng 1. Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg được ước tính và genotype của HBV ở các nước là nguồn gốc của trẻ em con nuôi quốc tế.
Nước |
Tỷ lệ mang HBsAg % |
Các genotype chiếm ưu thế |
Trẻ em được nhận làm con nuôi mỗi năm |
||||
|
Tổng cộng |
< 16 tuổi |
|
Mỹa |
Ýb |
Phápc |
Canadad |
Trung Quốc |
7,2 |
1,8 |
B, C |
3401 |
116 |
100 |
230 |
Liên bang Nga |
1,4-8 |
- |
D |
1079 |
707 |
301 |
66 |
Ethiopia |
4,7 |
- |
A |
2511 |
274 |
352 |
159 |
Haiti |
5 |
- |
A |
133 |
0 |
992 |
94 |
Korea |
5,9 |
0,9 |
C |
865 |
4 |
6 |
87 |
Colombia |
5,7 |
3,1 |
F |
235 |
592 |
369 |
25 |
Việt Nam |
10 |
7,5 |
B, C |
9 |
251 |
469 |
29 |
Ukraine |
1-2 |
- |
D |
450 |
426 |
59 |
35 |
Brazil |
1 |
0,8 |
A, D, F |
26 |
318 |
13 |
1 |
Đài Loan |
1,1* |
0,5 |
B, C |
282 |
3 |
3 |
6 |
Ấn Độ |
2-8 |
- |
A, D |
241 |
124 |
21 |
36 |
Philippine |
10 |
- |
B, C |
216 |
30 |
14 |
96 |
Ba Lan |
1-2 |
- |
A |
50 |
193 |
26 |
0 |
Nigeria |
4-12 |
12,4 |
E |
189 |
5 |
23 |
6 |
Kazakhstan |
3,8 |
- |
D |
181 |
28 |
46 |
45 |
Bulgaria |
2-7 |
- |
D |
40 |
128 |
8 |
2 |
Ghana |
11,4 |
- |
A |
117 |
0 |
2 |
9 |
Belarus |
4,8 |
- |
D |
0 |
99 |
0 |
1 |
Cambodia |
8 |
2-14 |
B, C |
0 |
87 |
2 |
1 |
Peru |
0,8-5,2 |
- |
F |
35 |
83 |
1 |
3 |
Hungary |
<1 |
- |
A, D |
5 |
78 |
5 |
0 |
Các nước khác |
|
|
|
993 |
584 |
692 |
261 |
Tổng cộng |
|
|
|
11.058 |
4130 |
3504 |
1192 |
* Tỷ lệ thu được từ nghiên cứu ở một sinh viên đại học năm thứ nhất 18 tuổi.
a Dữ liệu tham chiếu đến năm 2010 (Cục Lãnh sự, Bộ Ngoại giao Mỹ. US Intercountry Adoption [Internet]. adoption.state.gov 2011; [trích dẫn 10.01.12] Hiện có tại: http://adoption.state.gov/about_us/statistics.php). Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAgở Mỹ là 0,27% (0,03% ở độ tuổi 6-12) .
b Dữ liệu tham chiếu đến năm 2010 (Commission for intercountry adoptions. Data and perspectives in intercountry adoptions in Italy. Báo cáo ở các hồ sơ từ 1 tháng 1 đến 31 tháng 12, 2010. Commission for intercountry adoptions; 2011. Hiện có tại: http://commissioneadozioni.it/it/per-una-famiglia-adottiva/rapporto-statistico.aspx). Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg ở Ý là 0,9% .
c Dữ liệu tham chiếu đến năm 2010 (Agence française de l’adoption. Statistiques de l’adoption international 2010. [Internet]. France Diplomatie 2011; [trích dẫn 10.01.12] Hiện có tại: http://www.diplomatie.gouv.fr). Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg ở Pháp là 0,65% .
d Dữ liệu tham chiếu đến năm 2008 (HCCH Hague Conference Statistics. Canada: annual adoption statistics 2005–2009. [Internet]. HCCH 2012; [trích dẫn 10.01.12] Hiện có tại: http://www.hcch.net). Tỷ lệ mắc bệnh dựa trên kết quả dương tính của huyết thanh học đối với HBsAg ở Canada là 0,3-0,6% (0,4% đối với trước tuổi thiếu niên) .
Ngược lại, 1-5% trẻ em có HbeAg dương tính phát triển xơ gan . Từ 2% đến 5% trẻ em bị viêm gan B mạn tính phát triển ung thư biểu mô tế bào gan trong thời thơ ấu . Tỷ lệ mới mắc ung thư biểu mô tế bào gan ở các vùng bệnh lưu hành cao giảm đáng kể sau khi thực hiện các chương trình tiêm chủng . Trẻ em phát triển ung thư biểu mô tế bào gan có nhiều khả năng là nam giới (70%), bị xơ gan (80%) và trải qua sự chuyển đổi huyết thanh sớm, cho thấy viêm hoại tử trong quá trình chuyển đổi huyết thanh thành kháng thể kháng HBe có thể nặng, dẫn đến xơ gan và ung thư biểu mô tế bào gan . Nguy cơ lâu dài của cả ung thư biểu mô tế bào gan và xơ gan tương quan trực tiếp với sự sao chép virus và nồng độ HBV DNA trong huyết thanh . Vai trò của genotype virus về nguy cơ phát triển ung thư biểu mô tế bào gan vẫn đang được xác định: ở trẻ em, 80% ung thư biểu mô tế bào gan hiện diện ở bệnh nhân xơ gan genotype B trong khi ở bệnh nhân người lớn bị ung thư biểu mô tế bào gan hầu hết không xơ gan . Ở người lớn, các genotype C và F làm tăng nguy cơ bị ung thư biểu mô tế bào gan . Hơn nữa, nguy cơ này cao hơn ở những người có tiền sử gia đình về ung thư biểu mô tế bào gan và một vị trí nhạy cảm mới đã được mô tả gần đây ở 1p36.22 . Sự chuyển đổi huyết thanh thành kháng thể kháng HBe làm giảm nguy cơ tổng thể về phát triển ung thư biểu mô tế bào gan sau này trong cuộc đời nhưng tỷ lệ mới mắc hàng năm là 0,2% đã được mô tả ở người lớn có HbeAg âm tính (1,6% người mang HBsAg không có triệu chứng) .
Ở 5% trẻ em có kháng thể kháng Hbe dương tính, một đột biến ở vùng trước lõi được chọn, với sự sao chép virus kéo dài, nồng độ ALT bất thường và viêm gan hoạt động về mặt mô học (viêm gan mạn tính HbeAg âm tính). Trường hợp sau tiến triển chậm ở trẻ em, trong khi bệnh nhân người lớn có tăng nguy cơ xơ gan và ung thư biểu mô tế bào gan . Đáp ứng miễn dịch mạnh hơn với sự luân chuyển tế bào bị nhiễm virus nhanh hơn có thể giải thích sự tăng mức độ nặng như vậy và có thể thứ phát do giảm tiết tolerogen HbeAg .
Trong các nghiên cứu dài hạn theo thời gian, người ta thấy rằng 7-14% người mang virus không hoạt động bị mất HBsAg và trở thành có kháng thể kháng HBs (anti-HBs) dương tính. Sự chuyển đổi huyết thanh tự phát thành kháng thể kháng HBs là sự kiện hiếm gặp trong thời thơ ấu (1%/năm ở trẻ em bị lây nhiễm theo chiều ngang và 0,6%/năm ở trẻ em bị lây nhiễm chu sinh) . Sự làm sạch HBsAg và chuyển đổi huyết thanh thành kháng thể kháng HBs đánh dấu sự giải quyết nhiễm HBV và đi kèm bởi sự cải thiện mô học của gan. Tiên lượng lâu dài sau sự làm sạch HBsAg trong huyết thanh rất tốt nếu xảy ra trước khi phát triển xơ gan hoặc ung thư biểu mô tế bào gan và không có đồng nhiễm virus . Tuy nhiên, cccDNA vẫn tồn tại vô thời hạn trong tế bào gan và sự sao chép virus ở mức thấp hoặc sự tái hoạt virus do điều trị ức chế miễn dịch vẫn có thể gặp.
IV.Ai cần được điều trị và khi nào điều trị
Mặc dù một số hướng dẫn đã được công bố bởi các hội quốc tế lớn về việc quản lý bệnh nhân người lớn bị viêm gan B mạn tính, các chiến lược điều trị cho trẻ em vẫn đang tiến triển và chủ yếu dựa trên sự đồng thuận của các nhóm chuyên gia (Hình 1) . Việc quyết định bắt đầu một liệu pháp phải tính đến sự tiến triển nhẹ của bệnh trong thời thơ ấu đối với hầu hết các bệnh nhân và khả năng có những biến chứng nặng trong vài trường hợp chưa được xác định rõ và phức tạp do số lượng giới hạn của các thuốc được ghi nhãn sử dụng cho trẻ em.
Mục tiêu của trị liệu chống HBV ở trẻ em như ở người lớn là để làm giảm nguy cơ bệnh gan tiến triển, xơ gan và ung thư biểu mô tế bào gan. Điều này có thể đạt được bằng cách ức chế sự sao chép của virus thông qua sự chuyển đổi huyết thanh HBeAg lâu bền và nồng độ HBV DNA huyết thanh không phát hiện được. Giảm nồng độ virus huyết dẫn đến giảm viêm gan và bình thường hóa nồng độ ALT sau đó. Mục tiêu cuối cùng là chuyển đổi huyết thanh thành kháng thể kháng HBs, vì điều này làm ngừng tiến triển bệnh và làm giảm nguy cơ ung thư biểu mô tế bào gan, mặc dù nó xảy ra ở một thiểu số trẻ được điều trị .
Nên đánh giá lại sự cần thiết điều trị vào mỗi lần thăm khám theo dõi để điều trị ngay khi có các dấu hiệu sớm về tổn thương gan. Trẻ em bị viêm gan B mạn tính cần được khám thực thể và định lượng ALT, HBeAg/kháng thể kháng Hbe trong huyết thanh và nồng độ alpha-fetoprotein mỗi 6 tháng. Cần theo dõi ALT mỗi 3 tháng vào lúc chẩn đoán (trong 1 năm) và nếu tăng dai dẳng, và mỗi 12 tháng ở bệnh nhân HbeAg âm tính có tải lượng virus thấp (< 2000 IU/ml). Nên đánh giá nồng độ HBV DNA mỗi 12 tháng cùng với công thức máu toàn phần, xét nghiệm đầy đủ chức năng gan và siêu âm gan . Cần phải theo dõi suốt đời ngay cả đối với người mang virus không hoạt động vì nguy cơ xơ gan (7,8% bệnh nhân là 25 năm), ung thư biểu mô tế bào gan (2,2%) và tái hoạt của nhiễm HBV, với sự chuyển đổi huyết thanh thành HBeAg dương tính (1-4% bệnh nhân) hoặc tiến triển đến viêm gan HbeAg âm tính (15-24%) .

Hình 1. Ai cần được điều trị và khi nào điều trị: thuật toán để điều trị cho trẻ em và thanh thiếu niên bị viêm gan B mạn tính.
Quyết định điều trị cần dựa trên các thông số sau: nồng độ ALT, HBeAg dương tính, nồng độ HBV DNA, mô học của gan, tiền sử gia đình về xơ gan và/hoặc ung thư biểu mô tế bào gan, bệnh gan cùng tồn tại và lịch sử điều trị của bệnh nhân. Nồng độ ALT huyết thanh là chỉ điểm hữu ích nhất về tổn thương gan và nên được dùng để xác định những bệnh nhân có thể được xem xét để điều trị chống virus. Các bằng chứng đã công bố cho thấy bệnh nhân có ALT bình thường hoặc tăng nhẹ đáp ứng kém với các phương pháp điều trị hiện có . Lợi ích của việc điều trị cho trẻ em có ALT bình thường chưa được xác định và nguy cơ phát triển đề kháng với thuốc chống virus có thể biến nó thành có hại khi xem xét tương lai của những bệnh nhân này . Vì vậy, không nên điều trị cho trẻ em trong giai đoạn dung nạp miễn dịch ngoài các thử nghiệm lâm sàng, cần theo dõi và điều trị khi nồng độ ALT tăng cho thấy sự hoạt hóa miễn dịch. Ba thử nghiệm lâm sàng lớn nhất về các thuốc chống virus ở trẻ em đã sử dụng các nồng độ ALT cao hơn 1,5 lần giới hạn trên của mức bình thường (ULN) trong phòng xét nghiệm hoặc cao hơn 60 IU/L, tùy theo cái nào thấp hơn, là tiêu chuẩn thu nhận . Không may là giới hạn trên của mức bình thường (ULN) về nồng độ ALT chưa được xác định đối với trẻ em .
Nồng độ ALT huyết thanh phải tăng lên trong ít nhất 6 tháng (12 tháng nếu HbeAg âm tính) để tránh điều trị những bệnh nhân đang trải qua sự chuyển đổi huyết thanh HBeAg tự phát. Tăng ALT dai dẳng bắt buộc phải đánh giá nồng độ HBV DNA huyết thanh. Các trị số HBV DNA cao đòi hỏi phải điều trị, trong khi nồng độ HBV DNA thấp dẫn đến cần loại trừ các nguyên nhân khác của bệnh gan. Giá trị cắt (cut-off value) đối với HBV DNA chưa được xác định và giá trị tùy ý được sử dụng trong các thử nghiệm lâm sàng và các hướng dẫn. Vì trẻ em có tốc độ sao chép HBV cao hơn, trị số 20.000 IU/ml đã được chọn bởi các tác giả khác nhau . Tuy nhiên, các trị số thấp hơn có liên quan với bệnh gan tiến triển ở người lớn và các hướng dẫn xử trí mới nhất đã xác định 2,000 IU/ml là một giá trị cắt tốt .
Ở bệnh nhân người lớn trên 40 tuổi, việc điều trị có thể bắt đầu chỉ khi phát hiện tải lượng virus cao, vì nó là một yếu tố nguy cơ độc lập của xơ gan và ung thư biểu mô tế bào gan . Không có dữ liệu ở trẻ em để hỗ trợ cho cách tiếp cận này. Vì vậy, do đáp ứng với các phương pháp điều trị hiện có đối với trẻ em chỉ một phần và giới hạn ở các phân nhóm đặc trưng, việc đánh giá mô học về cấp độ viêm và giai đoạn xơ hóa vẫn được khuyến cáo trước khi điều trị cho trẻ. Đáp ứng với cả interferon (IFN)-alfa và chất tương tự nucleos(t)ide có nhiều khả năng khi có ít nhất viêm hoại tử trung bình hoặc xơ hóa trung bình được tìm thấy ở mô học của gan . Mặc dù lợi ích của việc điều trị chưa được xác định đối với trẻ em bị viêm hoặc xơ hóa nhẹ, tiền sử gia đình về ung thư biểu mô tế bào gan có thể đòi hỏi phải điều trị ngay cả ở những trẻ em có các thay đổi nhẹ về mô học vì những trẻ này có tăng nguy cơ phát triển ung thư biểu mô tế bào gan .
Có các nhóm trẻ em đặc biệt khác có tăng nguy cơ tiến triển bệnh nhanh (xơ gan, viêm thận-tiểu cầu liên quan với HBV, đồng nhiễm HDV, HCV hoặc HIV). Những bệnh nhân này có thể có lợi do việc điều trị ngay cả khi nồng độ ALT, HBV DNA và mô học của gan không phù hợp với giá trị cắt được nêu trên. Nên luôn xem xét một phương pháp điều trị chống virus ở người được ghép gan từ người hiến tặng có kháng thể kháng HBc dương tính và để phòng ngừa (hoặc điều trị) nhiễm HBV tái phát ở trẻ em trải qua ghép gan . Hơn nữa, điều trị dự phòng nên được sử dụng đối với bệnh nhân có HBsAg dương tính là người phải nhận được trị liệu ức chế miễn dịch hoặc gây độc tế bào vì nó làm giảm nguy cơ mắc bệnh và tử vong liên quan với sự tái hoạt của HBV .
Một số nghiên cứu được tiến hành ở người lớn cho thấy đáp ứng tốt hơn với interferon đối với các genotype A và B của virus so với D và C tương ứng .Ngược lại, không thấy sự khác biệt đáng kể khi các chất tương tự nucleoside được sử dụng . Không có nghiên cứu nào đã khảo sát vai trò của genotype đối với đáp ứng điều trị ở bệnh nhân trẻ em và hiện nay việc xác định genotype trước khi điều trị không được khuyến cáo .
V.Lựa chọn điều trị
Cục Quản lý Dược phẩm và Thực phẩm Mỹ (FDA) đã chấp thuận 4 loại thuốc để điều trị cho trẻ em bị viêm gan B mạn tính: IFNα, lamivudine, adefovir và entecavir. IFNα có thể được sử dụng ở trẻ em trên 12 tháng tuổi, lamivudine bắt đầu lúc 3 tuổi, adefovir ở trẻ em từ 12 tuổi trở lên và entecavir bắt đầu từ 16 tuổi. Mỗi loại trong những phương pháp điều trị này cùng với các loại khác hiện nay đang được nghiên cứu hoặc được sử dụng ngoài hướng dẫn ở các trung tâm tham chiếu, có các ưu điểm và nhược điểm (Bảng 2), tỷ lệ đáp ứng và đề kháng khác nhau (Hình 2).
Interferon-alfa
IFNα-2b là loại thuốc đầu tiên đã được chấp thuận và được sử dụng để điều trị viêm gan B mạn tính ở trẻ em trong khoảng 15 năm. Hiệu quả ở trẻ em tương tự như ở người lớn. Trong một thử nghiệm lớn nhất, đa trung tâm, ngẫu nhiên, có đối chứng về trị liệu IFNα cho trẻ em, 26% bệnh nhân đạt được đáp ứng virus (đáp ứng virus (VR): HBV DNA không phát hiện được và mất HBeAg) sau 24 tuần điều trị so với 11% ở nhóm chứng không được điều trị và 7% đáp ứng thêm trong 24 tuần sau khi ngừng điều trị. Tỷ lệ đáp ứng tăng đến 35% khi chỉ xem xét những bệnh nhân có ALT ít nhất gấp 2 lần giới hạn trên của mức bình thường. Nồng độ ALT giảm ở tất cả những người đáp ứng và bình thường ở 44% trường hợp vào lúc kết thúc điều trị. Chỉ số hoạt tính về mô học cải thiện ở những người đáp ứng và mất HBsAg xảy ra ở 10% trẻ được điều trị khi so với 1,2% ở nhóm chứng. Khả năng đáp ứng liên quan với nồng độ HBV DNA thấp trước khi điều trị, tuổi trẻ hơn và giới nữ . Đáp ứng tốt hơn ở bệnh nhân trẻ được xác nhận sau đó ở trẻ em dưới 5 tuổi .
IFNα được cho rằng chỉ đơn giản là đẩy nhanh sự chuyển đổi huyết thanh, vì nhiều bệnh không đáp ứng với điều trị vẫn có thể chuyển đổi huyết thanh thành kháng thể kháng HBe sau này trong cuộc đời. Trong 3 loạt khác nhau gồm 108, 107 và 174 trẻ em bị viêm gan B mạn tính, việc điều trị bằng IFNα cho thấy đẩy nhanh sự chuyển đổi huyết thanh HbeAg, nhưng những bệnh nhân được điều trị và không được điều trị có tỷ lệ làm sạch HbeAg tương tự trong thời gian theo dõi dài hạn (Hình 3) . Những dữ liệu này đã được xác nhận trong một nghiên cứu gần đây trên trẻ em châu Á. Hơn nữa, trẻ em có nguồn gốc châu Á chuyển đổi huyết thanh chậm hơn trẻ có nguồn gốc dân tộc khác, nhưng những trẻ này đạt đến cùng một tỷ lệ chuyển đổi huyết thanh trong theo dõi dài hạn . Trong một loạt gồm 74 trẻ em được theo dõi trong 7 năm, những bệnh nhân được điều trị có tăng nồng độ ALT lúc ban đầu cho thấy một tỷ lệ chuyển đổi huyết thanh cao hơn trong khi ALT tăng lúc ban đầu không ảnh hưởng đáng kể đến tỷ lệ chuyển đổi huyết thanh tự nhiên lâu dài ở trẻ em không được điều trị.
Bảng 2. Các phương pháp điều trị hiện có đối với viêm gan B mạn tính trong độ tuổi trẻ em.
Phương pháp điều trị |
Cấp phép |
Liều dùng |
Thời gian |
Ưu điểm |
Nhược điểm |
IFNα |
≥ 12 tháng |
5-10 triệu đơn vị/m2 tiêm dưới da 3 lần/tuần |
6 tháng |
Không đề kháng |
Tác dụng phụ nặng |
Lamivudine |
≥ 3 tuổi |
3 mg/kg đường uống, 1 lần/ngày |
≥ 1 năm |
Ít tác dụng phụ |
Tỷ lệ đề kháng cao (tăng lên theo thời gian điều trị) |
Adefovir |
≥ 12 tuổi |
10 mg đường uống, 1 lần/ngày |
≥ 1 năm |
Có hiệu quả một phần ở bệnh nhân đề kháng lamivudine |
Không được chấp thuận cho trẻ em < 12 tuổi |
Entecavir |
≥ 16 tuổi |
0,5 mg/ngày, 1 lần/ngày (1 mg/ngày đối với bệnh nhân đề kháng lamivudine) |
≥ 1 năm |
Có hiệu quả một phần ở bệnh nhân đề kháng lamivudine |
Tỷ lệ đề kháng khi điều trị dài hạn |
PegIFN |
Phase III |
180 μg/tuần |
6 tháng |
Không đề kháng |
Tác dụng phụ nặng |
Telbivudine |
Phase I |
600 mg/ngày, 1 lần/ngày |
≥1 năm |
Ít tác dụng phụ |
Tỷ lệ đề kháng cao |
Tenofovir |
Phase III |
300 mg/ ngày, 1 lần/ngày |
≥1 năm |
Tỷ lệ đáp ứng cao |
Không có chế phẩm cho trẻ nhỏ |
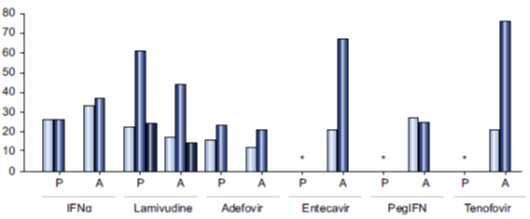
* Không có nghiên cứu
Hình 2. So sánh giữa các phương pháp điều trị hiện có về mặt chuyển đổi huyết thanh HBeAg (thanh màu xanh nhạt), HBV DNA không phát hiện được (thanh màu xanh) và xuất hiện đột biến kháng thuốc (thanh màu xanh đậm). Các thử nghiệm lâm sàng ở trẻ em (P) được so sánh với các nghiên cứu trên bệnh nhân người lớn (A).

| Tác giả và cộng sư | Bortolotti | Marx | Vo Thi Diem | Iorio | Hsu |
| Năm | 2000 | 2002 | 2005 | 2007 | 2008 |
| Theo dõi (năm) | 5 | 13 | 7 | 12 | 6 |
| n được điều trị/ không điều trị | 107/59 | 27/147 | 37/37 | 41/67 | 17/21 |
Hình 3. Tỷ lệ chuyển đổi huyết thanh ở trẻ em được điều trị bằng INF-alfa (thanh màu xanh nhạt) khi so với trẻ chưa được điều trị (thanh màu xanh đậm). Sự khác biệt giữa 2 nhóm ở mỗi nghiên cứu không có ý nghĩa thống kê.
Sự làm sạch HBsAg được quan sát thấy ở 4-15% trẻ em được điều trị bằng IFN (15-25% số người đáp ứng), so với 0-10% trẻ ở nhóm chứng . Sự khác biệt về tỷ lệ chuyển đổi huyết thanh HBsAg giữa bệnh nhân được điều trị và không được điều trị cho thấy có ý nghĩa trong các thử nghiệm ngẫu nhiên có đối chứng, trong khi không có nghiên cứu dài hạn nào có thể tìm thấy sự khác biệt có ý nghĩa thống kê như vậy. Tuy nhiên, trẻ em đáp ứng tức thì với IFN có nhiều khả năng mất HBsAg hơn so với người đáp ứng muộn hoặc không đáp ứng .
Nhìn chung, mặc dù các nghiên cứu ở trẻ em không cho thấy tác động của việc điều trị theo thời gian, các nghiên cứu bệnh-chứng lớn và các phân tích tổng hợp ở người lớn đã cho thấy IFNα làm giảm nguy cơ xơ gan (tỷ số nguy cơ (RR) 0,65) và ung thư biểu mô tế bào gan (tỷ số nguy cơ (RR) 0,59-0.66) trong theo dõi dài hạn .
Các khuyến cáo của hội nghị đồng thuận châu Âu đối với việc điều trị bằng IFNα đề nghị điều trị cho trẻ em từ 2 tuổi trở lên có HbeAg dương tính, nồng độ ALT bất thường và nồng độ HBV DNA thấp-trung bình. Chế độ điều trị được khuyến cáo là 5-10 triệu đơn vị/m2, 3 lần/tuần trong 6 tháng . Lợi ích của việc cung cấp trước bằng corticosteroid chưa được chứng minh . Chống chỉ định dùng IFNα ở trẻ em bị xơ gan mất bù, giảm tế bào máu, rối loạn tự miễn, suy tim hoặc suy thận và bệnh nhân được ghép tạng . Vì đáp ứng virus có thể đạt được trong 6 tháng sau khi kết thúc điều trị, cần chờ ít nhất 6-12 tháng trước khi bắt đầu một liệu pháp mới.
Các tác dụng phụ của việc điều trị bằng IFNα bao gồm sốt và triệu chứng giống cúm, rối loạn hành vi, rối loạn tiêu hóa và giảm bạch cầu trung tính. Hơn nữa, IFNα cho thấy ảnh hưởng tạm thời lên sự tăng trưởng . Tất cả các tác dụng phụ qua đi sau khi ngừng điều trị.
Pegylated interferon-alfa (PegIFN) chưa được chấp thuận để điều trị viêm gan B mạn tính ở trẻ em. Polyethylene glycol cộng với IFNα làm tăng thời gian bán hủy của nó, cho phép dùng 1 lần/tuần. Công thức này được cấp phép để sử dụng ở trẻ em bị viêm gan C mạn tính. Ở người lớn bị viêm gan B mạn tính, PegIFN đã được chứng minh là có hiệu quả trội hơn IFNα thông thường, với hồ sơ an toàn tương tự . Các thử nghiệm lâm sàng về PegIFN ở trẻ em bị viêm gan B mạn tính đang được tiến hành. Các báo cáo sơ bộ ở trẻ em bị nhiễm HCV cho thấy nó được dung nạp tốt trong khi dẫn đến tỷ lệ đáp ứng tốt hơn so với IFNα .
Lamivudine
Lamivudine là một chất tương tự pyrimidine nucleoside đã được chấp thuận để sử dụng cho trẻ em từ 3 tuổi trở lên. Trong một thử nghiệm lớn nhất trên trẻ em ngẫu nhiên, có đối chứng, đáp ứng virus đã đạt được ở 23% bệnh nhân dùng lamivudine sau 1 năm điều trị (so với 13% ở nhóm chứng). Đáp ứng tăng lên đến 35% khi chỉ xem xét những trẻ em có nồng độ ALT ít nhất gấp hai lần giới hạn trên của mức bình thường (ULN) . Một nghiên cứu mở rộng nhãn mở sau đó đã được thực hiện trên một nhóm đoàn hệ tương tự, đạt tổng cộng 2 hoặc 3 năm điều trị. Vào lúc kết thúc giai đoạn mở rộng, tỷ lệ đáp ứng là 56% đối với những trẻ em dùng lamivudine không có đột biến kháng thuốc (tỷ lệ 5% ở bệnh nhân có đột biến YMDD của HBV). Tỷ lệ đề kháng tăng theo thời gian (24% sau 1 năm điều trị, 49% lúc 2 năm và 64% lúc 3 năm) . Khả năng đáp ứng lớn hơn ở bệnh nhân có nồng độ ALT cao hơn và chỉ số hoạt tính về mô học cao hơn vào lúc ban đầu. Ở trẻ em, chưa có dữ liệu về tác động lâu dài của việc điều trị bằng lamivudine (hoặc bất kỳ chất tương tự nucleoside nào khác) lên lịch sử tự nhiên của bệnh.
Lamivudine được dung nạp tốt, không có tác dụng phụ đáng kể. Liều điều trị được khuyến cáo là 3 mg/kg/ngày (tối đa 100 mg/ngày) dùng đường uống, 1 lần/ngày. Một liều như vậy cung cấp mức tiếp xúc và nồng độ đáy tương tự như liều 100 mg ở người lớn . Thời gian điều trị tối ưu khó xác định hơn. Các dữ liệu đã công bố đề nghị tiếp tục điều trị cho đến khi đạt được đáp ứng virus và có thể dùng trong 6 tháng sau chuyển đổi huyết thanh . Vì thời gian điều trị dài hơn dẫn đến tỷ lệ đề kháng cao hơn, khuyến cáo ngừng dùng lamivudine sau 6 tháng nếu không đạt được sự ức chế sao chép virus hoàn toàn hoặc nếu xuất hiện đột biến YMDD. Vì có thể có các đợt bùng phát về ALT sau điều trị, các trẻ em cần được theo dõi cẩn thận và nên bắt đầu điều trị thay thế trong những trường hợp hiếm gặp về tăng ALT nặng và kéo dài .
Sự kết hợp lamivudine với IFNα (đồng thời hoặc tuần tự) đã được chứng minh là có hiệu quả hơn các loại thuốc dùng đơn độc ở bệnh nhân người lớn có nồng độ ALT tăng . Hai loại thuốc này đã được chứng minh là có tác dụng hiệp đồng trên các tế bào in vitro . Ở trẻ em, hiện có các dữ liệu ít hơn. Ba nghiên cứu đã khảo sát về trị liệu phối hợp ở 32, 33 và 45 trẻ em chưa từng được điều trị có nồng độ ALT tăng. Mặc dù không tìm thấy sự khác biệt giữa các chiến lược phối hợp khác nhau, các trẻ này đã đạt 30-60% về sự chuyển đổi huyết thanh thành kháng thể kháng HBe và 9-17% thành kháng thể kháng HBs . Một điều trị trong 8 tuần bằng lamivudine, tiếp theo là trị liệu phối hợp trong 10 tháng bằng lamivudine và IFN đã được thử nghiệm trên 23 trẻ em dung nạp miễn dịch: sự ức chế sao chép virus hoàn toàn đạt được ở 78% trẻ và 22% trẻ chuyển đổi huyết thanh thành kháng thể kháng HBe. Việc sử dụng đồng thời với IFNα dường như bảo vệ chống lại sự xuất hiện đột biến . Không tìm thấy sự khác biệt về đáp ứng mô học giữa đơn trị liệu và điều trị phối hợp . Vì cho đến nay chưa có các thử nghiệm lâm sàng lớn được thực hiện, các ưu điểm của điều trị phối hợp so với đơn trị liệu ở trẻ em vẫn còn đang được xác định.
Adefovir
Adefovir dipivoxil là một chất tương tự purine đã được chấp thuận để điều trị cho trẻ em bị viêm gan B mạn tính từ 12 tuổi trở lên. Trong một thử nghiệm lớn trên trẻ em, ngẫu nhiên, có đối chứng, 23% bệnh nhân từ 12-17 tuổi đã đạt được đáp ứng virus sau 48 tuần điều trị bằng adefovir (so với 0% trẻ được điều trị bằng giả dược). Hiệu quả ức chế HBV DNA và bình thường hóa ALT ít rõ ở các trẻ em nhỏ hơn (15% so với 3%), với sự khác biệt giữa các nhóm không có ý nghĩa thống kê . Adefovir được dung nạp tốt bởi trẻ em của tất cả các nhóm tuổi, không có đột biến liên quan với kháng thuốc được ghi nhận. Tuy nhiên, đột biến kháng adefovir đã được báo cáo ở hơn 20% người lớn có HbeAg dương tính sau 5 năm điều trị . Độc tính ống thận xa phụ thuộc liều, cùng với nhiễm toan ống thận như hội chứng Fanconi thỉnh thoảng gặp là một tác dụng phụ đã biết của adefovir, đã được báo cáo hiếm gặp ở người lớn nhưng không bao giờ gặp ở trẻ em. Độc tính đối với thận thường có thể hồi phục nếu nhanh chóng ngừng điều trị . Liều khuyến cáo ở bệnh nhân 12-18 tuổi là 10 mg dùng đường uống 1 lần/ngày. Thời gian điều trị chưa được xác định nhưng các chuyên gia đồng ý tiếp tục trong ít nhất 6 tháng sau chuyển đổi huyết thanh HBeAg. Nên ngừng điều trị bằng adefovir nếu không đạt được đáp ứng virus hoàn toàn sau 24 tuần hoặc nếu xuất hiện đột biến kháng thuốc. Cũng như với các chất tương tự nucleos(t)ide khác, cần theo dõi bệnh nhân sau khi ngừng dùng thuốc vì các đợt bùng phát sau điều trị không phải là ít gặp.
Entecavir
Entecavir là một chất tương tự carbocyclic của 20-deoxyguanosine đã được chứng minh là mạnh hơn cả lamivudine và adefovir ở bệnh nhân người lớn . Hơn nữa, hiếm gặp đề kháng entecavir, ngay cả sau 5 năm điều trị và entecavir có hoạt tính (mặc dù ít hiệu quả) trên các chủng kháng lamivudine . Hồ sơ an toàn của entecavir tương tự như của lamivudine. Dựa trên các nghiên cứu trên người lớn, entecavir đã được FDA chấp thuận để điều trị cho thanh thiếu niên từ 16 tuổi trở lên. Liều khuyến cáo là 0,5 mg, 1 lần/ngày đối với bệnh nhân chưa từng điều trị bằng nucleoside và 1 mg/ngày đối với bệnh nhân kháng lamivudine. Một thử nghiệm lâm sàng phase III ở trẻ em 2 tuổi đang được tiến hành .
Các thuốc mới
Telbivudine là một chất tương tự L-nucleoside có hoạt tính chống virus mạnh và một hồ sơ an toàn tương tự như lamivudine (mặc dù đã có báo cáo về bệnh cơ và bệnh thần kinh ngoại biên ở người lớn) . Tỷ lệ đề kháng thấp hơn so với lamivudine nhưng cao hơn adefovir. Vì lý do này, telbivudine chỉ được dùng phối hợp với các loại thuốc khác chống virus. Một thử nghiệm lâm sàng phase I đang được tiến hành trên trẻ em từ 2-18 tuổi .
Tenofovir disoproxil fumarate là một chất tương tự nucleos(t)ide đã được cấp phép để điều trị nhiễm HIV, có cấu trúc tương tự như adefovir và có hoạt tính chống virus tương đương. Tuy nhiên, vì nó đã được chứng minh là có độc tính đối với thận ít hơn so với adefovir, liều đã được chấp thuận cho người lớn cao hơn so với adefovir (300 mg/ngày). Vì lý do này, tenofovir cho thấy có hoạt tính chống virus cao hơn so với adefovir trong các thử nghiệm lâm sàng (HBV DNA không phát hiện được ở 76% bệnh nhân so với 13% người dùng adefovir sau 48 tuần điều trị) . Sau 3 năm điều trị, 72% bệnh nhân có HbeAg dương tính và 87% bệnh nhân có HbeAg âm tính có nồng độ HBV DNA < 400 bản sao (copies)/ml . Hồ sơ an toàn của tenofovir tương tự như của adefovir, mặc dù liên quan với giảm mật độ khoáng của xương ở trẻ em bị nhiễm HIV . Chưa có sự đề kháng genotype nào với tenofovir được xác nhận . Hiện nay tenofovir được sử dụng để điều trị nhiễm HIV ở trẻ em và đã được chứng minh là dung nạp tốt trong các nghiên cứu phase I tiến hành ở những bệnh nhân từ 4-18 tuổi . Vì không có chế phẩm thích hợp cho trẻ nhỏ, một thử nghiệm phase III đang được tiến hành trên những bệnh nhân từ 12-17 tuổi bị viêm gan B mạn tính .
VI.Đề xuất một phác đồ điều trị
Ngoài các thử nghiệm lâm sàng, cho đến khi các loại thuốc mới được cấp phép để dùng cho bệnh nhân trẻ em, IFNα vẫn là thuốc được lựa chọn, trừ khi bị xơ gan mất bù. Việc không thể phát triển đề kháng genotype chống lại loại thuốc như vậy là một ưu điểm lớn, mặc dù các phản ứng phụ rõ rệt hơn và lợi ích rõ về thời gian điều trị dài hạn vẫn còn đang được xác định. Hơn nữa, IFNα là loại thuốc duy nhất được cấp phép để điều trị cho trẻ em dưới 3 tuổi, mặc dù bệnh nhân ở nhóm tuổi này cần điều trị là cực hiếm. Các chất tương tự nucleos(t)ide hiện có là trị liệu hàng thứ hai, vì nguy cơ cao xuất hiện các chủng đột biến kháng thuốc. Ở thanh thiếu niên trên 16 tuổi, entecavir là lựa chọn tốt nhất vì ít có khả năng bị đề kháng. Nguy cơ này cao hơn với cả lamivudine và adefovir, loại sau thích hợp hơn ở trẻ em từ 12-15 tuổi. Việc sử dụng lamivudine hiện nay giới hạn chỉ ở trẻ nhỏ không đáp ứng với IFNα, ở các nhóm bệnh nhân đặc biệt (đồng nhiễm HIV, người được ghép tạng hoặc bệnh nhân bị viêm thận-tiểu cầu liên quan với HBV) hoặc để phòng ngừa tái hoạt ở trẻ em đang được điều trị ức chế miễn dịch. Liệu pháp phối hợp đầy hứa hẹn nhưng cần có dữ liệu thêm ở trẻ em.
Các loại thuốc mới hơn như PegIFN và tenofovir rất hứa hẹn và việc cấp phép sử dụng những thuốc này cho trẻ em có thể làm thay đổi việc quản lý viêm gan B mạn tính ở trẻ em. Vì sự xuất hiện các chủng đột biến kháng thuốc đang trở thành một vấn đề y tế công cộng lớn, các bác sĩ thực hành nhi khoa nên ngừng việc điều trị cho những trẻ em không thể có lợi từ việc trị liệu bằng một thuốc đã được cấp phép và nên xem xét chờ đợi các loại thuốc an toàn hơn và có hiệu quả hơn có được thông qua các thử nghiệm lâm sàng hoặc được chấp thuận đưa ra thị trường trong tương lai.
VII.Kết luận
Giảm đáng kể tỷ lệ nhiễm HBV ở trẻ em được quan sát thấy ở các nước đã thực hiện chương trình tiêm chủng toàn cầu. Tuy nhiên, một số lượng lớn trẻ em vẫn còn bị nhiễm virus mỗi năm. Dự phòng và quản lý nhiễm virus bùng phát, cùng với xác định tốt hơn các trẻ em có nguy cơ cao hơn về tiến triển bệnh và các biến chứng là những thách thức hiện nay.
Nhìn chung, việc quản lý bệnh nhân bị viêm gan B mạn tính là thỏa đáng, nhưng bị cản trở do sự chậm trễ lâu dài trong việc cấp phép cho các loại thuốc mới khi so với người lớn. Vì sự phê duyệt bởi các cơ quan quản lý dựa trên sự hoàn thành các thử nghiệm lâm sàng thích hợp, các nghiên cứu về các phương pháp điều trị mà ở người lớn đã được chứng minh là an toàn và có hiệu quả hơn các loại thuốc hiện tại nên được tiến hành mà không có sự chậm trễ không đáng có. Quy định hiện hành (2007) của châu Âu về thuốc dùng cho trẻ em cung cấp khung quy định thích hợp để đẩy mạnh quá trình này.